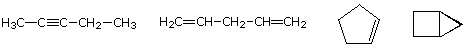Introduction
les alcènes et les alcynes sont des hydrocarbures qui ont respectivement des groupes fonctionnels à double liaison carbone-carbone et à triple liaison carbone-carbone. Les formules moléculaires de ces hydrocarbures insaturés reflètent la liaison multiple des groupes fonctionnels:
les alcènes sont nommés comme s’ils étaient des alcanes, mais le suffixe « -ane » est changé en « -en »., Si l’alcène ne contient qu’une seule double liaison et que cette double liaison est terminale (la double liaison se trouve à une extrémité de la molécule ou à une autre), il n’est pas nécessaire de placer un nombre devant le nom.,
butane: C4H10 (CH3CH2CH2CH3)
butène: C4H8 (CH2=CHCH2CH3)
Si la double liaison n’est pas terminale (si elle est sur un carbone quelque part au centre de la chaîne) alors les carbones doivent être numérotés une façon de donner au premier des deux carbones à double liaison le nombre le plus bas possible, et ce nombre doit précéder le suffixe « ENE » D’un tiret, comme indiqué ci-dessous.,
correct: pent-2-en (CH3CH=CHCH2CH3)
incorrect: pent-3-en (CH3CH2CH=CHCH3)
Le second est incorrect car le retournement horizontal de la formule donne un nombre inférieur pour l’alcène.
S’il y a plus d’une double liaison dans un alcène, toutes les liaisons doivent être numérotées dans le nom de la molécule – même les doubles liaisons terminales. Les nombres doivent aller du plus bas au plus haut, et être séparés les uns des autres par une virgule. Les préfixes numériques IUPAC sont utilisés pour indiquer le nombre de doubles liaisons.,
octa-2,4-diène: CH3CH=CHCH=CHCH2CH2CH3
deca-1,5-diène: CH2=CHCH2CH2CH=CHCH2CH2CH3
notez que la numérotation de « 2-4 » ci-dessus donne un molécule avec deux doubles liaisons séparées par une seule liaison. Les doubles liaisons dans une telle condition sont appelées « conjuguées », et elles représentent une stabilité accrue de la conformation, de sorte qu’elles sont énergétiquement favorisées en tant que réactifs dans de nombreuses situations et combinaisons.,
| Alcane | CnH2n+2 | Ceci est la valeur maximale du rapport H/C pour un nombre donné d’atomes de carbone. |
|---|---|---|
| Alcène | CnH2n | Chaque double liaison réduit le nombre d’atomes d’hydrogène par 2. |
La structure mère est la plus longue chaîne contenant à la fois des atomes de carbone de la double liaison., Les deux atomes de carbone d’une double liaison et les quatre atomes qui leur sont attachés se trouvent dans un plan, avec des angles de liaison d’environ 120° une double liaison consiste en une liaison sigma formée par chevauchement d’orbitales hybrides sp2 et une liaison pi formée par chevauchement d’orbitales parallèles 2 p
la Formule moléculaire d’un hydrocarbure fournit des informations sur les types structurels possibles qu’il peut représenter. Par exemple, considérons les composés ayant la formule C5H8., La formule du pentane alcane à cinq carbones est C5H12, donc la différence de teneur en hydrogène est de 4. Cette différence suggère que de tels composés peuvent avoir une triple liaison, deux doubles liaisons, un anneau plus une double liaison, ou deux anneaux. Quelques exemples sont présentés ici, et il y en a au moins quatorze autres!