Jusqu’à présent, nous avons examiné la façon dont des paires d’orbitales atomiques pourraient se combiner pour former des orbitales moléculaires to pour former des liaisons. Tout comme nous pensons qu’il y a une progression des orbitales atomiques de la plus basse énergie à la plus élevée (1s, 2s, 2p, 3s…), nous pouvons organiser ces orbitales moléculaires par ordre de leur énergie.
dans une large mesure, on peut considérer que l’ordre des orbitales moléculaires en énergie découle de l’ordre des orbitales atomiques à partir desquelles elles sont construites., Il y a quelques départs à partir de cette règle, parfois, mais c’est le plus simple pour commencer. Ainsi, dans une molécule, les orbitales moléculaires de plus faible énergie seraient celles formées à partir des orbitales atomiques de plus faible énergie, les orbitales 1s.
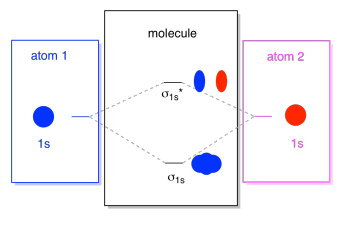
Ce que nous voyons ici est une orbitale moléculaire diagramme d’interaction. Le milieu du diagramme est juste le diagramme d’énergie orbitale moléculaire. Il est analogue au diagramme d’énergie orbitale atomique (qui va 1s, 2s, 2p, 3s…). L’ordre de l’énergie jusqu’à présent est σ1s, σ1s*., Les côtés du diagramme renvoient simplement à l’origine de ces orbitales moléculaires, avec des lignes pointillées pour vous guider d’un endroit à un autre. Dans l’ensemble, l’image indique que l’orbitale 1s sur un atome et l’orbitale 1s sur l’autre atome peuvent se combiner de deux manières différentes, produisant les σ1s de liaison à basse énergie et les σ1s anti-liaison à haute énergie*.
notez que nous n’avons pas encore ajouté d’électrons à ce diagramme d’énergie orbitale moléculaire, mais lorsque nous le ferons, nous les remplirons simplement de bas en haut, tout comme nous le ferions pour un diagramme d’énergie orbitale atomique.,
l’ensemble le plus bas suivant d’orbitales atomiques est le niveau 2s. Ces orbitales sphériques se combineraient très bien comme des orbitales 1s, et nous obtiendrions un diagramme similaire, seulement à un niveau d’énergie légèrement plus élevé.
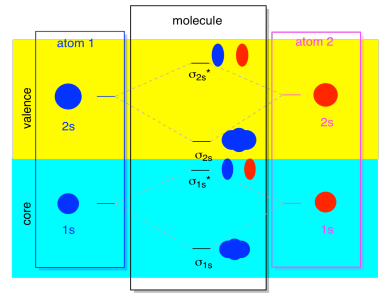
La plupart du temps, nous ne verrons pas à la fois les σ1 et les σ2 affichés dans le diagramme. C’est parce que s’il y a des électrons 2s, alors ces électrons 1s sont vraiment des électrons de base, Pas de valence. Ils sont enfouis un peu plus profondément dans l’atome, et ils ne jouent pas un rôle très important dans la liaison., Ignorer les électrons du noyau est assez courant; si vous vous souvenez, dans les configurations d’électrons atomiques, nous pourrions écrire 2s22p4 au lieu de 1s22s22p4 pour l’oxygène; nous ignorions le noyau. Lorsque nous avons dessiné les structures de Lewis, nous avons donné à l’oxygène six électrons, plutôt que huit; nous ignorions le noyau.
dans le contexte de MO, supposons que nous ayons des électrons 2s. Cela doit signifier que chaque atome a deux électrons 1s de sa propre, pour un total de quatre. Lorsque ces quatre électrons sont remplis dans le diagramme MO de bas en haut, ils occuperont à la fois la liaison σ1s et l’antibondage σ1s*., L’effet de ces combinaisons étant occupé est d’annuler la liaison; ces deux paires d’électrons restent non liant. Nous pouvons donc les ignorer et nous ne manquons vraiment de rien.
les orbitales 2s ne sont pas les seules dans le deuxième shell. Il existe également des orbitales 2p. Rappelez-vous, il existe plusieurs façons très différentes de combiner les orbitales p, en fonction de leur axe. Si ils ne mentent pas parallèles les uns aux autres-c’est, si elles sont perpendiculaires les uns aux autres, comme un px et py — puis ils ne peuvent pas interagir les uns avec les autres à tous., Le pz sur un atome peut interagir avec le pz sur l’autre atome, cependant, parce qu’ils sont parallèles les uns aux autres.
Habituellement, nous définissons l’axe z comme étant situé le long de la ligne entre les deux atomes que nous regardons. Deux orbitales pz se situeraient le long de cet axe, chacune avec un lobe s’étendant dans l’espace entre les atomes, et chacune avec un autre lobe s’étendant loin, dans l’autre direction
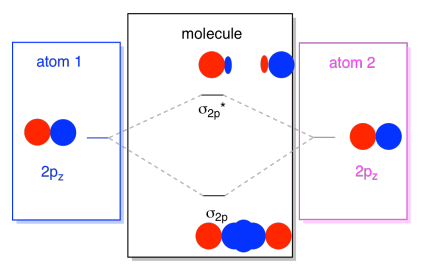
les combinaisons résultantes sont appelées σ parce qu’elles se trouvent le long de l’axe entre les atomes (c’est exactement ce que σ signifie, en termes de liaison)., Il existe une combinaison σ, si les lobes qui se chevauchent sont en phase les uns avec les autres, et une combinaison σ*, si ces lobes sont déphasés les uns avec les autres. Parce que ces nouvelles orbitales proviennent des orbitales atomiques 2P, nous les appelons σ2p et σ2p*.
Il y a aussi ces orbitales p qui ne se trouvent pas le long de l’axe de liaison, ou l’axe entre les deux atomes. Les orbitales px sont perpendiculaires aux orbitales pz que nous venons de regarder, et donc perpendiculaires à l’axe entre les liaisons. Cependant, ils sont toujours parallèles les uns aux autres, et ils peuvent toujours former des combinaisons., Ces deux orbitales formeraient une combinaison en phase et une combinaison hors phase.
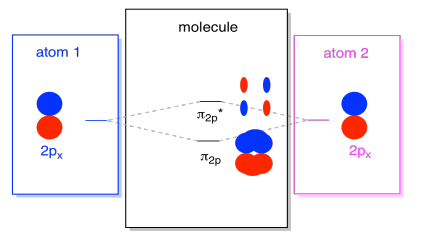
notez que la séparation énergétique entre ces deux combinaisons est un peu plus petite que l’écart entre les niveaux σ2p et σ2p*. La différence est liée au degré de chevauchement entre les orbitales atomiques. Les orbitales sur l’axe projettent fortement dans le même espace; elles se chevauchent beaucoup et interagissent fortement. Les orbitales hors axe se frottent les unes contre les autres, interagissant moins fortement et entraînant des changements énergétiques plus petits., L’écart entre l’orbitale n2p et l’orbitale n2p* est donc beaucoup plus petit que celui entre les orbitales σ2p et σ2p*.
Il y a en fait deux de ces orbitales p hors axe. En plus de l’ensemble px, nous aurions un ensemble py. Si l’ensemble px est dans le plan de l’écran, l’ensemble py a une orbitale qui dépasse devant et une cachée derrière. Néanmoins, les combinaisons entre les deux py orbitales sont exactement les mêmes que ce que nous avons vu entre les deux orbitales px. Ils sont juste tournés dans un plan perpendiculaire par rapport aux combinaisons px.,
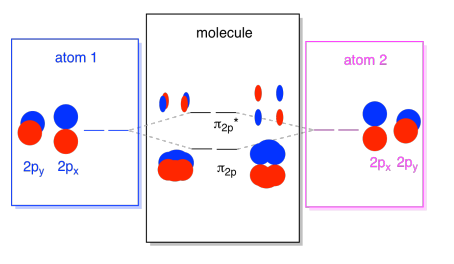
On peut mettre toutes ces 2p-fondé orbitales ensemble dans un diagramme. Il commence à être un peu plus encombré, mais ce diagramme n’est qu’une combinaison des pièces que nous avons déjà vues. Notez que les orbitales atomiques px, py et pz commencent toutes à la même énergie (nous les avons empilées ici pour que vous puissiez toujours voir la corrélation entre les orbitales atomiques et moléculaires). Cela signifie que le n2p & n2p* orbitales sera « imbriqués » entre les σ2p & σ2p* orbitales.,
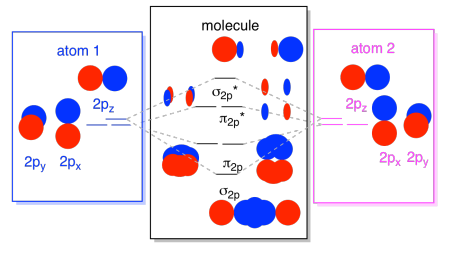
enfin, en gardant à l’esprit que les orbitales 2p sont plus énergétiques que les orbitales 2s, nous pouvons combiner ces images en un seul diagramme. Encore une fois, nous avons déjà vu ces pièces individuelles; nous ne faisons que les assembler maintenant.
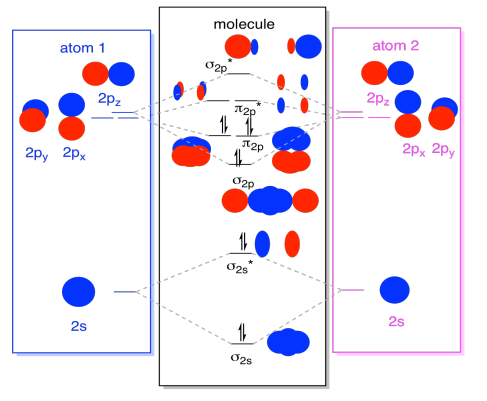
Pendant que nous y sommes, nous pouvons peut ajouter dans les électrons. Comment? C’est juste le nombre total d’électrons de valence. Pour un exemple, nous avons utilisé N2., Chaque azote a cinq électrons de valence, pour un total de dix, nous venons donc de remplir dix électrons, en commençant au bas du diagramme de niveau d’énergie orbitale moléculaire. S’il s’agissait d’une autre molécule, telle que F2 ou O2, nous construirions le diagramme global de la même manière, mais utiliserions simplement un nombre différent d’électrons.
l’image orbitale que nous avons décrite ci-dessus n’est en réalité qu’une image potentielle de la structure électronique du dinitrogène (et de tout autre groupe principal ou bloc p diatomique)., Nous n’aurons pas une image réelle de la structure de l’azote tant que nous n’aurons pas rempli ces niveaux potentiels d’électrons.
- Seuls les niveaux d’énergie avec les électrons ont un effet sur l’énergie (et le comportement) de la molécule.
En d’autres termes, l’énergie des électrons détermine le comportement de la molécule. Les autres niveaux d’énergie ne sont que des possibilités qui ne sont pas réalisées.
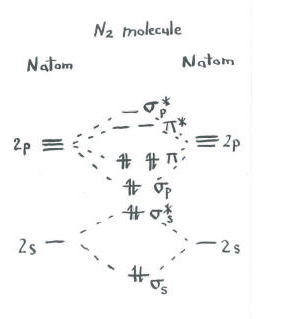
Pensez à l’image de diazote.
- Chaque azote a cinq électrons de valence.
- Il y a un total de dix électrons.,
- deux vont chacun dans les niveaux de liaison s s et d’antibondage s s*. Rappelez-vous, nous avons gardé ces séparés de l’ensemble p comme une simplification.
- deux vont chacun dans la liaison s p et chacun des niveaux de liaison p.
les orbitales restantes (s p* antibonding et chacun des niveaux p * antibonding) sont inoccupées. Ce sont des niveaux imaginaires qui ne jouent pas un rôle dans la détermination de l’énergie du dinitrogène. Dans un calcul d’orbitale moléculaire réelle, les électrons de ces niveaux contribueraient à l’énergie globale de la molécule.,
nous obtenons des informations supplémentaires à partir de cette image. Par exemple, nous pouvons voir l’ordre de liaison dans dinitrogen.
- L’ordre des liaisons est juste le nombre de liaisons entre une paire d’atomes.
- l’ordre des liaisons est l’un des nombreux facteurs qui influencent la force de la liaison covalente.
- Plus l’ordre de liaison est élevé, plus les électrons sont partagés entre les atomes et plus la liaison est forte.
En dinitrogen, les niveaux de liaison ss s* antibonding s’annulent mutuellement. Une paire est plus faible en énergie que dans l’atome, mais l’autre est plus élevée., Il n’y a pas d’abaissement net de l’énergie. Ces électrons ne contribuent pas à une liaison azote-azote. Ce sont des paires d’électrons non collantes.
Les six électrons dans la liaison s p et les niveaux de liaison p, cependant, représentent une diminution de l’énergie par rapport aux niveaux d’énergie dans les atomes d’azote libres. Ces trois paires d’électrons de faible énergie indiquent trois liaisons entre les atomes d’azote.
rappelez-vous, nous avons fait quelques raccourcis dans cette image, et un vrai calcul d’orbitale moléculaire pourrait donner des résultats légèrement différents., Néanmoins, il révélerait toujours un ordre de liaison de trois ainsi que deux paires d’électrons non-liaison.
de plus, des images orbitales moléculaires sont parfois montrées de différentes manières. Un diagramme d’interaction orbitale moléculaire montre comment les orbitales atomiques ou moléculaires se combinent pour créer de nouvelles orbitales. Parfois, nous pouvons nous intéresser uniquement aux niveaux d’énergie orbitale moléculaire eux-mêmes, et non à leur origine. Un diagramme de niveau d’énergie orbitale moléculaire montre simplement les niveaux d’énergie dans la molécule., Souvent, mais pas toujours, les diagrammes de niveau d’énergie sont affichés sans aucune image des orbitales, afin de concentrer l’attention sur les niveaux d’énergie, qui sont d’une manière fondamentale la partie la plus importante de l’image. De plus, comme seuls les niveaux d’énergie occupés contribuent réellement à l’énergie de la molécule, les orbitales inoccupées de plus haute énergie sont parfois laissées de côté.

très souvent, les résultats des calculs d’orbitales moléculaires renforcent ce que nous pourrions prédire à partir des structures de Lewis., Si vous dessinez une structure de Lewis de dinitrogen, vous prédisez également une triple liaison azote-azote. Le principal avantage de la théorie des orbitales moléculaires est qu’elle permet une prédiction quantitative de l’énergie lorsque nous faisons un calcul réel sur un ordinateur. De plus, il est important de se rendre compte qu’il n’y a pas de véritable raison pour la règle de l’octet à moins que nous ne considérions la mécanique quantique. Les structures de Lewis sont fondées sur une observation empirique selon laquelle les électrons forment des paires et des octets, sans tenter d’expliquer pourquoi., La théorie des orbitales moléculaires prend certaines relations fondamentales de la physique et les applique à des molécules très compliquées avec un très bon succès. Juste en connaissant le nombre d’électrons dans la molécule, et en sachant approximativement où se trouvent les noyaux dans la structure, les calculs orbitaux moléculaires donnent des informations très utiles sur l’énergie. De plus, dans des cas plus compliqués que N2, ces calculs peuvent même corriger notre première estimation de la géométrie moléculaire et de l’emplacement des liaisons.,
Exercise \(\PageIndex{2}\)
Un diagramme D’orbitale moléculaire pour une molécule diatomique (deux atomes) varie en nombre d’électrons. Comment voulez-vous remplir les électrons?
réponse
* comptez les électrons de valence sur la molécule. C’est le nombre d’électrons de valence sur chaque atome, ajusté pour n’importe quelle charge sur la molécule. (par exemple, C22-a 10 électrons de valence: 4 de chaque carbone that c’est 8 and et deux de plus pour la charge 2).
• remplissez d’abord les électrons dans les orbitales d’énergie les plus basses.
• Paire d’électrons après toutes les orbitales au même niveau d’énergie ont un électron.,
exercice \(\PageIndex{3}\)
construire un diagramme Orbital moléculaire qualitatif pour le chlore, Cl2. Comparez l’ordre de liaison à celui observé dans la structure de Lewis (rappelez-vous qu’un électron dans une orbitale antibondante annule la stabilisation due à la liaison d’un électron dans une orbitale de liaison).
Réponse: 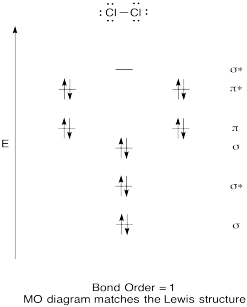
l’Exercice de \(\PageIndex{4}\)
- Construire un qualitatives diagramme des orbitales moléculaires pour l’oxygène, O2.
- comparez l’ordre de liaison à celui observé dans la structure de Lewis.,
- comment cette image MO de l’oxygène se compare-t-elle à la structure de Lewis? Que vous disent les deux structures sur l’appariement des électrons?
- des Composés qui ont tous leurs électrons appariés sont appelés diamagnétique. Ceux avec des électrons non appariés sont appelés paramagnétiques. Les matériaux paramagnétiques sont attirés par un champ magnétique, mais les choses diamagnétiques ne le sont pas. Comment vous attendez-vous à ce que l’oxygène moléculaire se comporte?,
Réponse
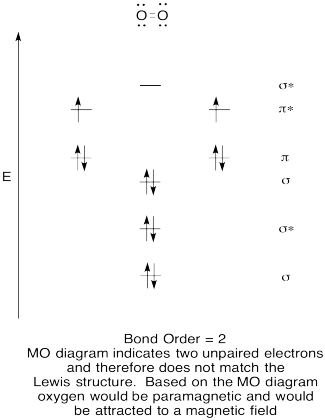
l’Exercice de \(\PageIndex{5}\)
- Construire une qualitative des orbitales moléculaires diagramme de peroxyde d’anions, O22-.
- comparez l’ordre de liaison à celui observé dans la structure de Lewis.
- comment cette image MO de l’oxygène se compare-t-elle à la structure de Lewis? Que vous disent les deux structures sur l’appariement des électrons?,
- sur la base d’images orbitales moléculaires, avec quelle facilité pensez-vous que le dioxygène pourrait être réduit en peroxyde (par l’ajout de deux électrons)?
Réponse
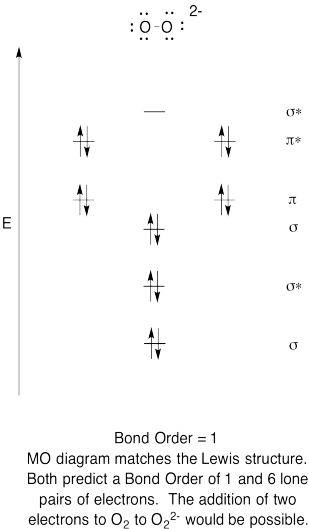
l’Exercice de \(\PageIndex{6}\)
la Construction d’un qualitatives diagramme des orbitales moléculaires pour diboron, B2. Pensez-vous que les liaisons bore-bore pourraient se former facilement, sur la base de cette image?,
Réponse:
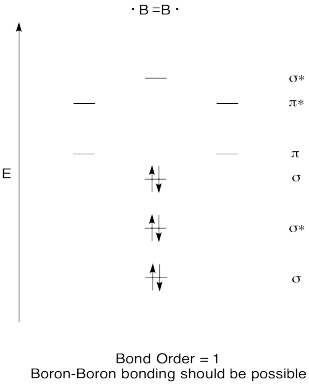
l’Exercice de \(\PageIndex{7}\)
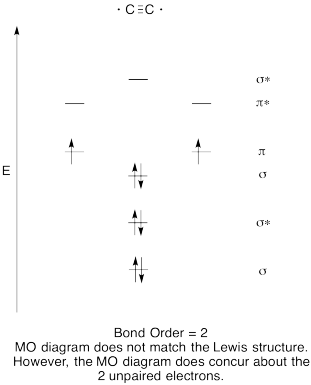
- Construire un qualitatives diagramme des orbitales moléculaires pour dicarbon, C2.
- comparez l’ordre de liaison à celui observé dans la structure de Lewis.
- comment cette image MO de l’oxygène se compare-t-elle à la structure de Lewis? Que vous disent les deux structures sur l’appariement des électrons?,
Réponse
l’Exercice de \(\PageIndex{8}\)
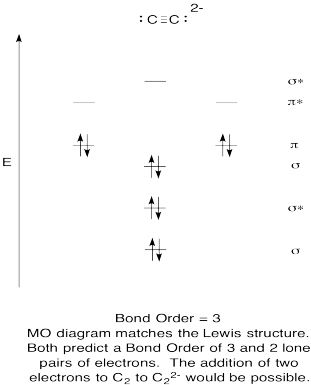
- Construire un qualitatives diagramme des orbitales moléculaires pour acetylide anions, C22-.
- comparez l’ordre de liaison à celui observé dans la structure de Lewis.
- comment cette image MO de l’oxygène se compare-t-elle à la structure de Lewis? Que vous disent les deux structures sur l’appariement des électrons?,
- sur la base d’images orbitales moléculaires, avec quelle facilité pensez-vous que le dicarbon pourrait être réduit en acétylide (par l’ajout de deux électrons)?
Réponse
l’Exercice de \(\PageIndex{9}\)
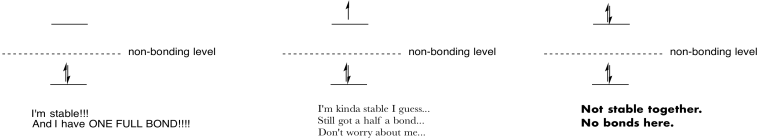
Faire des dessins et des notes pour résumer l’effet de remplissage antibonding orbitales.
Réponse:
l’Attribution
Chris P Schaller, D. tél.,, (Collège Saint-Benoît / Université Saint-Jean)