el estudio de la cinética permite a los científicos determinar la relación entre los cambios en las condiciones y la velocidad de una reacción química particular. Uno de los factores más importantes que afectan a la velocidad de una reacción es la reactividad de los productos químicos involucrados en esa reacción específica; además, hay varias variables que también pueden afectar la velocidad de una reacción (concentración, temperatura, catalizador, etc.).).
Una de estas variables se considera una colisión.,
cada reacción química requiere colisiones entre las partículas reactivas (átomos y/o moléculas). Por otro lado, no todas las colisiones promueven que la reacción tenga lugar. En cambio, si las partículas que chocan no tienen suficiente energía cinética o una orientación adecuada en el espacio, la reacción no ocurrirá.
Pero ¿qué se entiende por «suficiente energía»o» orientación adecuada»? Para tener una mejor idea de los conceptos mencionados anteriormente, el artículo proporcionará algunas definiciones generales acompañadas de ejemplos y problemas de muestra correspondientes.,
nuestro principal objetivo es definir el concepto de energía de activación y explicar por qué algunas de las colisiones no dan lugar a una reacción.
en consecuencia, este artículo se centrará principalmente en el concepto de colisión reactiva. Junto con eso, veremos brevemente algunos escenarios que involucran colisiones no reactivas. Dado que las colisiones están asociadas con dos características principales, la energía y la orientación espacial, también discutiremos estos Términos.,
teoría de colisiones
como ya hemos mencionado anteriormente, las colisiones entre dos o más moléculas deben ocurrir para que tenga lugar una reacción química. Pero la colisión no es suficiente para que los reactivos se transformen en productos. Las moléculas deben tener suficiente energía, y deben colisionar con la orientación espacial correcta.
como usted ya sabe, hay diferentes tipos de reacciones, incluyendo síntesis, descomposición, desplazamiento y combustión., Teniendo en cuenta el hecho de que la teoría de colisiones se centra en las reacciones que implican colisiones entre dos especies, no tiene que preocuparse mucho por las reacciones de descomposición, ya que, en tales casos, un solo compuesto se cae a pedazos, y no hay necesidad de considerar las colisiones u orientación de las partículas en el espacio.
en el caso de reacciones que involucran a dos especies, las colisiones entre las moléculas son cruciales para que la reacción proceda; pero, solo las colisiones de moléculas con suficiente energía cinética y orientación espacial relevante pueden causar una reacción., Por lo tanto, la energía es necesaria para romper los enlaces dentro de las moléculas que reaccionan, mientras que la orientación de las moléculas en el espacio juega un papel importante en alinear átomos adecuados entre sí para reformar los enlaces rotos de la manera adecuada.
cuando se cumplen ambos criterios, la colisión se considera una colisión exitosa, efectiva o reactiva.
teniendo en cuenta la importancia de los dos factores mencionados anteriormente (energía y orientación), debemos continuar la explicación de los términos y conceptos para comprender mejor los principios de la teoría de colisiones.,
energía de activación
como ya hemos mencionado anteriormente, las partículas deben chocar con suficiente energía para que ocurra una reacción. Esta energía mínima requerida para que la reacción proceda se define como la energía de activación.,
como usted puede saber, Hay dos tipos de reacciones relacionadas con la liberación o absorción de energía que son los siguientes:
- reacción endotérmica: la energía se absorbe en una reacción (generalmente en formas de calor)
- reacción exotérmica: la energía se libera en una reacción (generalmente en formas de calor)
a primera vista, podría parecer que, dado que la energía se libera en una reacción exotérmica, no debería haber ninguna necesidad de reacción a ocurrir. Por el contrario, tanto las reacciones químicas endotérmicas como las exotérmicas requieren energía para comenzar.,
parece un poco extraño, ¿verdad? ¿Por qué una reacción necesita la entrada de energía si la energía se libera en consecuencia?
consideremos los siguientes ejemplos de reacciones exotérmicas que ocurren en nuestra vida cotidiana.

Ejemplo #1 – la Quema de una Vela
La quema de una vela libera energía en forma de calor; por lo tanto, la reacción que se produce durante el proceso es exotérmico. Obviamente, es necesario encender la vela con un fósforo o encendedor., Lo que esto significa es que tienes que introducir algo de energía para que la vela se encienda. Después de eso, la reacción tiene suficiente energía para proceder a los siguientes pasos, y la vela continúa quemando energía.
sin embargo, una vela nunca estallará en llamas por sí sola, ¿verdad?
Ejemplo #2 – encender un fósforo

Un típico partido de cabeza está compuesto de azufre mezclado con diferentes agentes oxidantes. Para encender la cerilla, debe frotar la cabeza de la cerilla contra el lado Especial de una caja de cerillas., Durante este proceso, se produce una reacción que libera energía en forma de luz y calor. Por lo tanto, la reacción se considera exotérmica. Aunque, todavía necesita introducir algo de energía para que la cerilla comience a arder. Esta energía se define a través del término «energía de activación.»De manera similar al ejemplo anterior, siempre y cuando proporcione suficiente energía para que la cerilla se encienda, continuará quemándose y liberando calor por sí sola.
el gráfico de energía de activación representa los cambios de energía que ocurren durante una reacción química.,
para trazar el gráfico de energía de activación, es crucial considerar dos variables:
- Número de colisiones entre diferentes moléculas
- Energía Cinética de las moléculas colisionantes
la primera variable es bastante fácil de entender ya que tiene un significado directo: define el número de colisiones entre las partículas de dos especies por segundo.
la segunda variable es la energía cinética de las moléculas que chocan, que se puede definir como la energía del movimiento de las moléculas.
- reacción endotérmica: la energía se absorbe., La energía de los reactivos es menor que la energía de los productos.
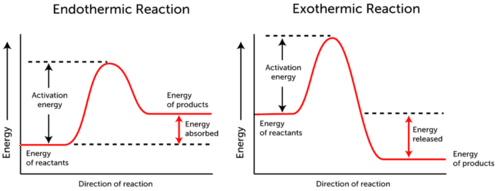
- Exotérmica de la Reacción se libera energía. La energía de los reactivos es más que la energía de los productos.
como se puede ver en los dos gráficos anteriores, la energía de activación para ambas reacciones, endotérmica y exotérmica es la misma.,
dado que la reacción endotérmica no puede producir tanta energía como necesita consumir para que ocurra la reacción, la energía se absorbe; por lo tanto, la energía de los productos es mayor que la energía de los reactivos.
por el contrario, las reacciones exotérmicas producen más energía de la que utilizan como energía de activación. Como resultado, la energía se libera, y los productos tienen menor energía que los reactivos.,
como conclusión, se puede afirmar que incluso si las moléculas reactivas chocan rápidamente entre sí, es esencial que las moléculas tengan suficiente energía para que ocurra la reacción.
orientación espacial
de acuerdo con la teoría de colisiones, no todas las colisiones son exitosas, incluso si las moléculas reactivas tienen suficiente energía de activación. Las moléculas también deben colisionar de la manera correcta.
por lo tanto, el segundo aspecto que influye en las colisiones reactivas se considera que es la orientación espacial (orientación de las moléculas en el espacio).,
¿Qué se entiende por la orientación «adecuada» de las moléculas en una reacción?
Cuando dos moléculas chocan, ambas moléculas deben estar situadas de manera que sea fácil para ellas reaccionar. Para entender completamente el concepto, es importante resaltar el mecanismo de la reacción.
consideremos la reacción entre propileno (o propeno) y bromuro de hidrógeno como un ejemplo:

como puede ver arriba, la reacción procede en 2 pasos.,
Paso 1: se rompe el doble enlace
Paso 2: se une el bromo
en esta reacción, las orientaciones moleculares de HBr y C3H6 juegan un papel importante ya que si una de ellas estaba situada de otra manera, no habría sido posible que el átomo H se acercara a la molécula de propileno.
Esto es cierto para cada reacción. Cada molécula debe tener la orientación adecuada en el espacio para que la reacción tenga lugar. La orientación correcta asegura que las moléculas estén situadas de manera que sea relativamente fácil para ellas colisionar y reaccionar.,
podemos concluir que la orientación favorable de las moléculas reactivas es tan esencial como suficiente energía de activación.
resumen
los Términos y conceptos definidos a lo largo del artículo se resumen en la siguiente tabla:
| teoría de colisiones | explica cómo las partículas deben interactuar o el uno al otro para causar una reacción., Según la teoría de la colisión, se deben cumplir dos criterios para que una reacción química tenga lugar: las moléculas deben colisionar con suficiente energía de activación para romper y volver a formar los enlaces existentes; las moléculas deben colisionar con una orientación espacial favorable. |
| colisión exitosa (también conocida como colisión efectiva o reactiva) | una colisión de moléculas con suficiente energía de activación y una orientación adecuada en el espacio que resulta en una reacción química., |
| energía de activación | la energía mínima que se requiere para que ocurra la reacción. La entrada de energía es necesaria en caso de reacciones endotérmicas y exotérmicas. |
| reacción endotérmica | la energía (calor) se absorbe; la energía de los reactivos es menor que la energía de los productos; no puede producir tanta energía como consume durante la reacción., |
| Reacción Exotérmica | Energía (calor) se libera; La energía de los reactivos es MAYOR que la energía de los productos; Puede producir más energía de la que consume durante la reacción. |
| Orientación Molecular | orientación Espacial de las moléculas., |
Three different scenarios are represented in the picture attached below:
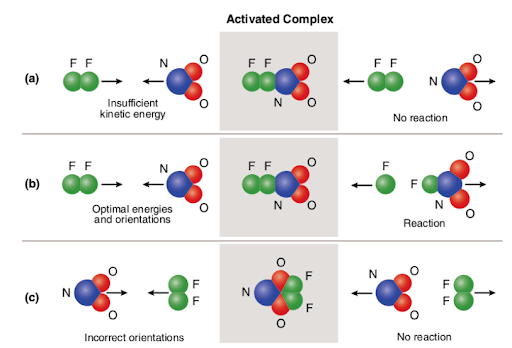
The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride.,
en el caso de (a), las moléculas reactivas tienen una orientación espacial adecuada pero no tienen suficiente energía de activación; por lo tanto, la reacción no ocurre debido al hecho de que no hay suficiente energía para romper los enlaces. Por lo tanto, la colisión entre las dos moléculas se considera no reactiva.
en el caso de (b), las moléculas reactivas tienen suficiente energía de activación y una orientación adecuada en el espacio. Debido a las características óptimas de las moléculas, la reacción procede y se forma oxifluoruro de nitrógeno., Por lo tanto, la colisión entre las dos moléculas se considera reactiva.
en el caso de (c), Las moléculas reactivas tienen suficiente energía de activación pero no están correctamente situadas en el espacio; por lo tanto, la reacción no tiene lugar ya que no es posible que las moléculas se alcancen entre sí de la manera que rompe los enlaces. Así, de manera similar al primer caso, la colisión entre las dos moléculas se considera no reactiva.