objetivos de aprendizaje
- Para obtener una comprensión de la teoría de colisiones.
- Para obtener una comprensión de los cuatro factores principales que afectan la velocidad de reacción.
la cinética de reacción es el estudio de la tasa de reacciones químicas, y las tasas de reacción pueden variar mucho en un amplio rango de escalas de tiempo. Algunas reacciones pueden proceder a velocidades explosivamente rápidas como la detonación de fuegos artificiales (Figura 17.,1 «fuegos artificiales por la noche sobre el río»), mientras que otros pueden ocurrir a un ritmo lento durante muchos años como la oxidación del alambre de púas expuesto a los elementos (figura 17.2 «alambre de púas oxidado»).
figura 17.1. Fuegos artificiales por la noche sobre el río

la reacción química en los fuegos artificiales ocurre a un ritmo explosivo.
figura 17.2. Alambre de púas oxidado

la oxidación del alambre de púas ocurre durante muchos años.,
teoría de colisiones
para comprender la cinética de las reacciones químicas y los factores que afectan a la cinética, primero debemos examinar lo que sucede durante una reacción a nivel molecular. De acuerdo con la teoría de colisión de reactividad, las reacciones ocurren cuando las moléculas reactivas «colisionan efectivamente.»Para que ocurra una «colisión efectiva», las moléculas reactivas deben estar orientadas correctamente en el espacio para facilitar la ruptura y formación de enlaces y el reordenamiento de átomos que resultan en la formación de moléculas producto (Figura 17.3″visualizaciones de colisión»).
figura 17.3., Visualizaciones de colisión
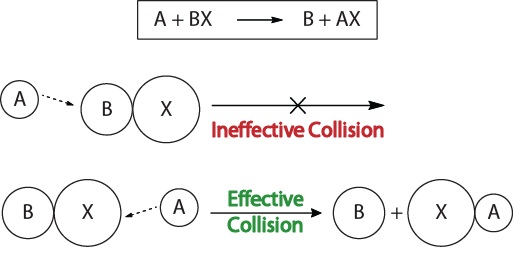
esta visualización muestra una colisión ineficaz y efectiva basada en la orientación molecular.
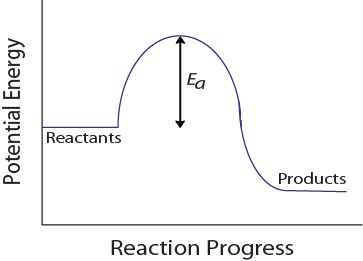
durante una colisión molecular, las moléculas también deben poseer una cantidad mínima de energía cinética para que ocurra una colisión efectiva. Esta energía varía para cada reacción, y se conoce como energía de activación (Ea) (figura 17.4 «energía potencial y energía de activación»)., Por lo tanto, la velocidad de reacción depende de la energía de activación; una energía de activación más alta significa que menos moléculas tendrán suficiente energía para sufrir una colisión efectiva.
figura 17.4. Energía potencial y energía de activación
factores que afectan la velocidad
Hay cuatro factores principales que pueden afectar la velocidad de reacción de una reacción química:
1. Concentración de reactivos., El aumento de la concentración de uno o más reactivos a menudo aumentará la velocidad de reacción. Esto ocurre porque una mayor concentración de un reactivo conducirá a más colisiones de ese reactivo en un período de tiempo específico.
2. Estado físico de los reactivos y superficie. Si las moléculas reactivas existen en diferentes fases, como en una mezcla heterogénea, la velocidad de reacción estará limitada por el área de superficie de las fases que están en contacto., Por ejemplo, si un reactivo de metal sólido y un reactivo de gas se mezclan, solo las moléculas presentes en la superficie del metal son capaces de chocar con las moléculas de gas. Por lo tanto, aumentar el área de superficie del metal golpeándolo plano o cortándolo en muchas piezas aumentará su velocidad de reacción.
3. Temperatura. Un aumento en la temperatura normalmente aumenta la velocidad de reacción. Un aumento en la temperatura elevará la energía cinética promedio de las moléculas reactivas., Por lo tanto, una mayor proporción de moléculas tendrá la energía mínima necesaria para una colisión efectiva (figura. 17.5 «temperatura y velocidad de reacción»).
figura. 17.5 temperatura y velocidad de reacción
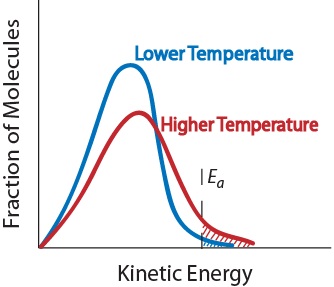
4. Presencia de un catalizador. Un catalizador es una sustancia que acelera una reacción participando en ella sin ser consumida. Los catalizadores proporcionan una vía de reacción alternativa para obtener productos., Son fundamentales para muchas reacciones bioquímicas. Se examinarán más a fondo en la sección «catálisis.»
conclusiones clave
- Las reacciones ocurren cuando dos moléculas reactivas chocan efectivamente, cada una con una energía mínima y una orientación correcta.
- La concentración de reactivos, el estado físico de los reactivos y el área de superficie, la temperatura y la presencia de un catalizador son los cuatro factores principales que afectan la velocidad de reacción.