categoría: química
Publicado: 9 de diciembre de 2013
Sí, el agua puede permanecer líquida por debajo de cero grados Celsius. Hay algunas maneras en que esto puede suceder.
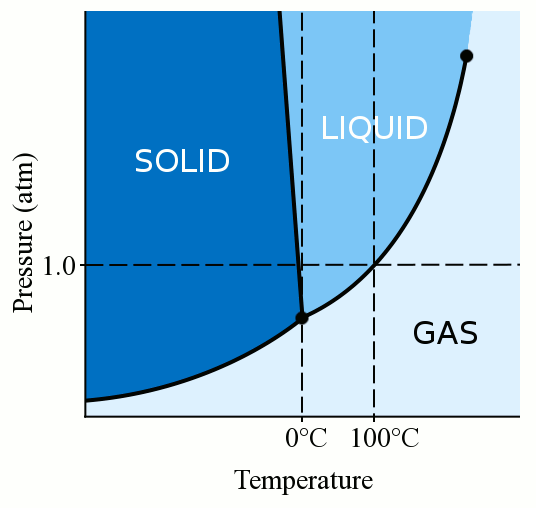
En primer lugar, la fase de un material (ya sea gas, líquido o sólido) depende en gran medida de su temperatura y presión., Para la mayoría de los líquidos, la aplicación de presión aumenta la temperatura a la que el líquido se congela a sólido. Un sólido se forma cuando las moléculas sueltas y serpenteantes de un líquido se vuelven lo suficientemente lentas y lo suficientemente cercanas para formar enlaces estables que las fijan en su lugar. Cuando aplicamos presión a un líquido, forzamos a las moléculas a acercarse. Por lo tanto, pueden formar enlaces estables y convertirse en sólidos incluso si tienen una temperatura más alta que el punto de congelación a presión estándar. El agua es algo único, sin embargo. Las moléculas de agua se extienden cuando se unen a una estructura cristalina sólida., Esta acción de dispersión hace que el hielo sea menos denso que el agua líquida, haciendo que el hielo flote. Esta acción de dispersión de las moléculas de agua durante la congelación también significa que la aplicación de presión sobre el agua reduce el punto de congelación. Si aplicas suficiente presión (lo que dificulta que las moléculas de agua se extiendan hacia la estructura sólida), puedes tener agua líquida varios grados bajo cero grados Celsius.
incluso si no aplica presión, aún puede tener agua líquida a temperaturas bajo cero utilizando aditivos., Los aditivos como la sal pueden interferir con la unión química necesaria para formar un sólido y, por lo tanto, pueden reducir el punto de congelación del agua. La sal está compuesta de iones fuertes de sodio y cloro. Cuando se disuelven en agua, las moléculas de agua tienden a pegarse a los iones de sal en lugar de uno al otro, y por lo tanto no se congelan tan fácilmente. A medida que agrega más sal al agua, su punto de congelación continúa cayendo hasta que el agua alcanza la saturación y no puede contener más sal. Si agrega suficiente sal, el punto de congelación del agua puede caer tan bajo como -21 grados Celsius., Este hecho significa que el agua a -21 grados Celsius aún puede permanecer líquida si se agrega suficiente sal. En lugar de evitar que el agua líquida se congele, esta poderosa propiedad de la sal también se puede usar para convertir el hielo en agua. Rociar sal en las aceras heladas reduce el punto de congelación del hielo por debajo de la temperatura ambiente y el hielo se derrite. Pero rociar sal en pasillos helados no ayudará si la temperatura ambiente está por debajo de -21 grados Celsius. El efecto de la sal en el punto de congelación del agua también tiene efectos profundos en los océanos de la tierra.,
incluso si no aplica presión y no agrega nada al agua, aún puede tener agua líquida a temperaturas por debajo de cero grados Celsius. Para que el agua se congele y se congele, necesita algo sobre lo que congelarse para iniciar el proceso. Llamamos a estos puntos de partida «centros de nucleación». En la mayoría de las situaciones, un poco de polvo, impurezas o incluso pequeñas vibraciones en el agua proporcionan centros de nucleación para que el agua se congele. Pero si su agua es muy pura y muy quieta, no hay nada para que las moléculas de agua se cristalicen., Como resultado, puede enfriar agua muy pura muy por debajo de cero grados Celsius sin que se congele. El agua en esta condición se llama «subenfriado». A presión estándar, el agua pura se puede sobreenfriar hasta unos -40 grados centígrados. El agua superenfriada no se congela solo por la falta de centros de nucleación. Por lo tanto, una vez que se proporcionan los centros de nucleación (lo que podría ser tan simple como una vibración), el agua superenfriada se congela rápidamente. La lluvia helada es un ejemplo natural de agua líquida superenfriada., Una vez que la lluvia helada golpea un objeto en la superficie de la tierra, ese objeto proporciona Centros de nucleación, y la lluvia se congela hasta convertirse en hielo.
temas: congelación, Punto de congelación, lluvia helada, hielo, diagrama de fases, presión, sobreenfriado, temperatura, agua