Richard Baxter y Jim Britton
¿cómo se corroe el acero en el agua?
para comprender la protección catódica, primero debe comprender cómo se causa la corrosión. Para que se produzca la corrosión, deben estar presentes tres cosas:
1. Dos metales diferentes
2. Un electrolito (agua con cualquier tipo de sal o sales disueltas en ella)
3., Una trayectoria metálica (conductora) entre los metales diferentes
los dos metales diferentes pueden ser aleaciones totalmente diferentes, como el acero y el aluminio, pero es más probable que sean diferencias metalúrgicas microscópicas o macroscópicas en la superficie de una sola pieza de acero. En este caso, consideraremos el acero que se corroe libremente, que no es uniforme.
si las condiciones anteriores existen, la siguiente reacción tiene lugar en los sitios más activos: (dos iones de hierro más cuatro electrones libres).,
2FE => 2Fe++ + 4e –
Los electrones libres viajan a través de la trayectoria del metal a los sitios menos activos, donde tiene lugar la siguiente reacción: (el gas de oxígeno se convierte en ion de oxígeno – mediante la combinación con los cuatro electrones libres – que se combina con el agua para formar iones hidroxilo).
O2 + 4e- + 2h20 => 4 OH-
Las recombinaciones de estos iones en la superficie activa producen la siguiente reacción, que produce el producto de corrosión del hierro hidróxido ferroso: (combinación de hierro con oxígeno y agua para formar hidróxido ferroso).,
2FE + O2 + 2H2O => 2Fe (OH)2
Esta reacción se describe más comúnmente como ‘flujo de corriente a través del agua desde el ánodo (sitio más activo) al cátodo (sitio menos activo).’
¿cómo detiene la corrosión la protección catódica?
La protección catódica previene la corrosión al convertir todos los sitios anódicos (activos) en la superficie metálica a sitios catódicos (pasivos) al suministrar corriente eléctrica (o electrones libres) de una fuente alternativa.
generalmente esto toma la forma de ánodos galvánicos, que son más activos que el acero., Esta práctica también se conoce como un sistema de sacrificio, ya que los ánodos galvánicos se sacrifican para proteger el acero estructural o la tubería de la corrosión.
en el caso de los ánodos de aluminio, la reacción en la superficie de aluminio es: (cuatro iones de aluminio más doce electrones libres)
4Al => 4AL+++ + 12 e –
y en la superficie del acero: (gas de oxígeno convertido en iones de oxígeno que se combinan con agua para formar iones hidroxilo).,
3O2 + 12e – + 6H20 = > 12OH –
mientras la corriente (electrones libres) llegue al cátodo (acero) más rápido que el oxígeno, no se producirá corrosión.,
consideraciones básicas al diseñar sistemas de ánodos de sacrificio
la corriente eléctrica que descarga un ánodo está controlada por la Ley de Ohm, que es:
I=E/R
I= flujo de corriente en amperios
E= diferencia de potencial entre el ánodo y el cátodo en voltios
R= resistencia total del circuito en ohmios
inicialmente, la corriente será alta porque la diferencia de potencial entre y el cátodo son altos, pero como la diferencia de potencial disminuye debido al efecto del flujo de corriente en el cátodo, la corriente disminuye gradualmente debido a la polarización del cátodo., La resistencia del circuito incluye tanto la trayectoria del agua como la trayectoria del metal, que incluye cualquier cable en el circuito. El valor dominante aquí es la resistencia del ánodo al agua de mar.
para la mayoría de las aplicaciones, la resistencia del metal es tan pequeña en comparación con la resistencia al agua que puede ignorarse (aunque esto no es cierto para trineos o tuberías largas protegidas de ambos extremos). En general, los ánodos largos y delgados tienen menor resistencia que los ánodos cortos y grasos. Descargarán más corriente, pero no durarán tanto tiempo.,
Por lo tanto, un diseñador de protección catódica debe dimensionar los ánodos para que tengan la forma y el área de superficie adecuadas para descargar suficiente corriente para proteger la estructura y suficiente peso para durar la vida útil deseada al descargar esta corriente.
como regla general:
la longitud del ánodo determina cuánta corriente puede producir el ánodo y, en consecuencia, cuántos pies cuadrados de acero se pueden proteger. La sección transversal (Peso) determina cuánto tiempo el ánodo puede sostener este nivel de protección.,
sistemas de protección catódica de corriente impresionada (sistemas de ánodos ICCP)
debido a las altas corrientes involucradas en muchos sistemas de agua de mar, no es raro usar sistemas de corriente impresionada que usan ánodos de un tipo (ánodos ICCP) que no se disuelven fácilmente en iones metálicos. Esto provoca una reacción alternativa: la oxidación de los iones cloruro disueltos.
2cl- => Cl2 + 2E –
La alimentación es suministrada por una unidad de alimentación de CC externa.,

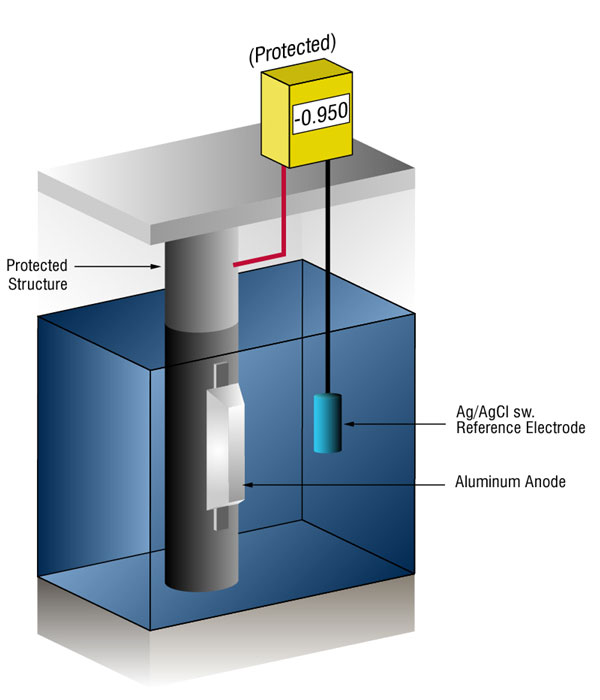
¿Cómo sabemos cuándo tenemos suficiente protección catódica?
podemos verificar que hay suficiente corriente midiendo el potencial del acero contra un electrodo de referencia estándar, generalmente plata plata / cloruro (Ag / AgCl sw.), pero a veces zinc (sw.).
el flujo de corriente sobre cualquier metal cambiará su potencial normal en la dirección negativa. La historia ha demostrado que si el acero recibe suficiente corriente para cambiar el potencial de (-) 0.800 V vs, silver / silver chloride (Ag / AgCl), the corrosion is essentially stopped.
 |
 |