Introducción
sin embargo, varios estudios en animales han demostrado que el CBD produce curvas dosis-respuesta en forma de U invertidas. Estas curvas se describieron por primera vez en ratas probadas en el modelo de ansiedad elevated plus maze (EPM) (Guimarães et al., 1990). En ese estudio, el CBD aumentó la exploración de brazo abierto (un efecto similar al ansiolítico) a dosis de 2.5-10 mg/kg, pero no a 20 mg/Kg (Guimarães et al., 1990)., Se han descrito curvas de dosis-respuesta similares en forma de campana en otros estudios que investigan los efectos del CBD en el comportamiento. Por ejemplo, el pez cebra tratado con 0.5 mg/kg de CBD pasó significativamente más tiempo en la zona superior del acuario (lo que se interpreta como un efecto ansiolítico), mientras que el comportamiento de los peces tratados con las dosis más bajas (0.1 mg/kg) y más altas (5 y 10 mg/kg) no difirió de los controles (Nazario et al., 2015). Un patrón similar también se observó en ratas espontáneamente hipertensas (SHRs), que presentan un fenotipo conductual tipo esquizofrenia., La inhibición del prepulso en esta cepa de ratas se invirtió en 30 mg/kg de CBD, pero no en las dosis de 15 y 60 mg/kg (Levin et al., 2014). Lo mismo se observó utilizando el modelo de deterioro cognitivo inducido por reserpina en ratas, un modelo animal de enfermedad de Parkinson y discinesia tardía. Mientras que el CBD, a la dosis de 0,5 mg/kg, atenuó el déficit de memoria inducido por reserpina en la tarea discriminativa, la dosis de 5 mg/kg resultó ineficaz (Peres et al., 2016).,
existe una clara necesidad de explorar nuevas formas de manejar los trastornos de ansiedad, ya que su tratamiento sigue siendo problemático y generalmente involucra una combinación de medicamentos, incluyendo benzodiazepinas y antidepresivos. Estos medicamentos tienen sus desventajas, como el riesgo de dependencia y síndrome de abstinencia, efectos secundarios sexuales, deterioro cognitivo y psicomotor, inicio retardado de la acción (antidepresivos), baja aceptación y requisito de un control cuidadoso de la dosis (Katzman et al., 2014; Bandelow et al., 2015; Sgnaolin et al., 2016)., El CBD no parece inducir efectos adversos significativos en los seres humanos (Bergamaschi et al., 2011b). Sin embargo, desde una posible perspectiva terapéutica, es esencial determinar si un patrón de dosis-respuesta similar en forma de U invertida también está presente en humanos. Para investigar esta posibilidad, elegimos uno de los efectos más consistentes del CBD, la disminución aguda de la ansiedad. Este efecto se ha descrito en varios modelos animales y en voluntarios sanos y pacientes con trastorno de ansiedad social (SAD) (Guimarães et al., 1990; Zuardi et al., 1993; Bergamaschi et al., 2011a; Crippa et al.,, 2011); sin embargo, no se ha investigado el uso de dosis múltiples en humanos.
un método ampliamente utilizado para inducir ansiedad experimental en humanos es la tarea de hablar en público simulado (SPST – Graeff et al., 2003). El SPST es muy consistente en elevar la ansiedad auto-calificada. Sin embargo, sus efectos sobre las respuestas fisiológicas (frecuencia cardíaca, presión arterial y secreción de cortisol) son menos consistentes (Palma et al., 1994; Hetem et al., 1996; de-Paris et al., 2003)., Un metaanálisis de 11 estudios que utilizaron el SPST confirmó esta observación, mostrando un aumento significativo en el tamaño del efecto general sobre la ansiedad subjetiva, pero no sobre la presión arterial sistólica (PAS) y la frecuencia cardíaca (Zuardi et al., 2013). La escasa evidencia en la literatura sugiere que hablar en público en una situación de la vida real es más eficiente para aumentar las respuestas fisiológicas (Turner et al., 1990; Dickerson y Kemeny, 2004). En un estudio reciente, comparamos la prueba de hablar en público en una situación real (TPSRS) y el SPST., Los resultados mostraron que ambos métodos fueron efectivos en el aumento de la ansiedad subjetiva, pero solo el TPSRS aumentó la frecuencia cardíaca, la PAS y la presión arterial diastólica (pad) (Zuardi et al., 2013).
el presente estudio, por lo tanto, fue diseñado para probar la hipótesis de que el aumento de dosis de CBD produciría efectos ansiolíticos en un patrón de dosis-respuesta en forma de U invertida en voluntarios sanos sometidos al TPSRS.,
materiales y métodos
sujetos
sesenta hombres y mujeres sanos de 18-35 años, sin antecedentes de enfermedad psiquiátrica pasada o actual, alcohol u otra dependencia de drogas fueron reclutados a través de publicidad en el campus de la Universidad de São Paulo en Ribeirão Preto. No se incluyeron participantes con condiciones médicas importantes o que estaban tomando medicamentos con el potencial de interferir con los resultados del estudio., Los voluntarios fueron entrevistados para evaluar la elegibilidad y medir su propensión a la ansiedad a través de la versión de rasgo del inventario de ansiedad estado-rasgo de Spielberger (STAI – Spielberger et al., 1970). Los participantes elegibles que aceptaron participar fueron instruidos a abstenerse de drogas en la semana previa a las pruebas y de alcohol y cafeína en las 24 h previas a la prueba., Todos los voluntarios dieron su consentimiento informado por escrito para participar después de haber sido plenamente informados de los procedimientos de investigación, que se ajustaron a los términos actuales de la Declaración de Helsinki y fueron aprobados por el Comité de Ética del Hospital Universitario de la Facultad de Medicina de Ribeirão Preto (HCRP-No.12407/09).
Los voluntarios fueron asignados aleatoriamente a cinco grupos con 12 sujetos cada uno para recibir diferentes dosis de CBD (100, 300 y 900 mg), clonazepam (1 mg) o placebo en un diseño aleatorizado doble ciego., Los grupos fueron emparejados de acuerdo con el sexo, la edad, el índice de masa corporal (IMC) y la puntuación stai-trait. Un voluntario del grupo CBD-300 no pudo asistir a la sesión experimental debido a problemas personales y fue retirado del estudio.
drogas
El polvo de Cannabidiol con una pureza del 99,6% (sin otros cannabinoides presentes) disuelto en aceite de maíz en dosis de 100 y 200 mg/ml fue proporcionado amablemente por Biosynthesis Pharma Group (BSPG-Pharm, Sandwich, Reino Unido). La solución de CBD, las tabletas de clonazepam (Rivotril®, Roche Lab) y el placebo (aceite de maíz) se envasaron en cápsulas de gelatina idénticas., Todos los voluntarios recibieron cinco cápsulas de un mililitro cada una, en las siguientes combinaciones: cinco cápsulas que contienen aceite de maíz (grupo placebo); una cápsula de CBD 100 mg/ml y cuatro cápsulas de aceite de maíz (grupo CBD-100); tres cápsulas de CBD 100 mg/ml y dos cápsulas de aceite de maíz (grupo CBD-300); cuatro cápsulas de CBD 200 mg/ml y una cápsula de CBD 100 mg/ml (grupo CBD-900); y una cápsula con clonazepam y cuatro cápsulas de aceite de maíz (clonazepam grupo – clon)., Cada tratamiento recibió un número aleatorio y tanto el investigador encargado de dispensar las cápsulas como el voluntario desconocían su contenido (doble ciego). Finalmente, la elección del intervalo entre la administración del fármaco y el TPSRS se basó en estudios farmacológicos previos que mostraban que las concentraciones plasmáticas máximas de CBD y CLON tomadas por vía oral generalmente se producen entre las 2 y 3 h después de la ingestión (Agurell et al., 1981; Crevoisier et al., 2003; Borgwardt et al., 2008; Fusar-Poli et al., 2009; Martin-Santos et al., 2012)., El CBD experimenta un efecto significativo de primer paso que conduce a la formación de una serie de metabolitos y su semivida en humanos se encontró entre 2 y 5 días después de la administración oral. La biodisponibilidad del CBD oral en humanos es de alrededor del 6%, lo que respalda la opinión de que tiene un efecto sustancial de primer paso (Zhornitsky y Potvin, 2012). El nivel plasmático medio de CBD a las 1, 2 y 3 h después de la administración aguda de 600 mg fue de 0,36, 1,62 y 3,4 ng/ml, respectivamente (Martin-Santos et al., 2012)., La elección de las dosis utilizadas en este estudio se basó en evidencia previa que mostraba que la administración oral aguda de 300 mg de CBD tenía efectos ansiolíticos en el SPST (Zuardi et al., 1993).
mediciones psicológicas
Se utilizaron dos factores de la escala visual analógica del Estado de ánimo (VAMS), traducida y validada al portugués por Zuardi y Karniol (1981), para evaluar los niveles de ansiedad y los efectos sedantes durante la prueba. El VAMS es un instrumento autoadministrado que consta de 16 ítems. Antes del TPSRS, cada voluntario se sometió a una sesión de capacitación para completar la escala., Se pidió a los sujetos que marcaran el punto que identificaba su estado subjetivo Actual en una línea recta de 100 mm colocada entre dos palabras que describen estados de ánimo opuestos (por ejemplo, tiempo relajado). Un análisis factorial de la versión portuguesa de la escala identificó cuatro factores (Zuardi et al.,, 1993): (1) ‘ansiedad’, que comprende los elementos calmado–excitado, relajado–tenso y tranquilo–preocupado; (2) ‘sedación’, que incluye los elementos alerta–somnoliento y atento–soñador; (3) ‘deterioro cognitivo’, que incluye ingenioso-mentalmente lento, competente–incompetente, energético–letárgico, lúcido–muzzy, gregario-retraído, bien coordinado–torpe y fuerte–débil; y (4) ‘malestar’, que incluye los elementos interesado-aburrido, feliz–triste, contento–descontento, y amistoso–antagonista (parente et al., 2005). Desde estudios previos con ambos ansiogénicos (Crippa et al., 2004; Parente et al.,, 2005)y medicamentos ansiolíticos como el CBD (Crippa et al., 2004, 2011; Bergamaschi et al., 2011a) han demostrado que solo los factores de ansiedad y sedación presentan cambios durante las tareas de oratoria, utilizamos solo los ítems de estos factores del VAMS para reducir el tiempo de administración y permitir la ejecución del protocolo. Este procedimiento se utilizó previamente en el estudio de validación del PSRST (Zuardi et al., 2013).
las mediciones fisiológicas
la presión arterial sistólica, la PAD y la frecuencia cardíaca (FC) se midieron con un esfigmomanómetro digital (Omron, Brasil).,
prueba de hablar en público en una situación Real (TPSRS)
en este procedimiento, cada sujeto debe hablar frente a un grupo y, en la misma sesión experimental, participar en la audiencia cuando los otros miembros del grupo estén hablando. Se instruye al público a permanecer en silencio y con una expresión neutral durante los discursos.
se realizaron cinco sesiones experimentales con 12 sujetos cada una (excepto 1, que incluyó 11 sujetos). Al comienzo de la sesión, se informó a los voluntarios del número de tratamientos que recibirían (como se detalló anteriormente)., Los voluntarios fueron entonces instruidos para tomar asientos marcados con sus respectivos números de tratamiento. Los asientos estaban numerados de tal manera que, al final de las cinco sesiones, los sujetos de cada grupo de tratamiento habían ocupado todas las posiciones posibles. La secuencia de procedimientos siempre siguió el mismo orden desde la primera hasta la duodécima silla en un esfuerzo por minimizar un posible efecto de orden en la secuencia de oradores., Por ejemplo, los temas del grupo CDB-300 ocuparon las siguientes posiciones: primera sesión – 3, 8; Segunda Sesión – 4, 9; Tercera Sesión – 5, 10; cuarta sesión – 1, 6, 11; quinta sesión – 2, 7, 12.
procedimiento
Los voluntarios comenzaron la sesión experimental después de un mínimo de 6 h de sueño y 2 h después de comer un desayuno estándar (200 ml de leche con chocolate y 100 g de pan con margarina).,
los 12 voluntarios se sentaron en sillas dispuestas en semicírculo, siguiendo un orden predeterminado por el número de tratamiento asignado a cada uno de ellos y realizaron las mediciones basales, seguido de la ingesta de las cinco cápsulas dentro de un intervalo de 5 minutos para cada voluntario. Esta fase se completó durante un período de 1 h. los voluntarios luego vieron una película sobre aves de la selva amazónica que duró unos 20 min. Después de eso, las mediciones se repitieron con un intervalo de 5 min para cada sujeto (medida pretest)., 2 h y 20 min después de que el primer voluntario hubiera recibido el tratamiento, todos vieron un video de aproximadamente 10 min con instrucciones grabadas para la prueba del habla. 2 h y 30 min después de que el primer voluntario recibió el tratamiento, comenzaron a realizar la prueba del habla, que duró 5 min. Posteriormente, los otros voluntarios fueron sometidos a la prueba del habla en el mismo orden en que habían recibido los tratamientos., La prueba de discurso consistió en preparar silenciosamente un discurso de 1 minuto sobre un tema relacionado con «las condiciones de un servicio público de su ciudad», elegido por casualidad entre 12 opciones y revelado inmediatamente antes de la preparación del discurso. El discurso preparado se presentó durante 2 min, con los otros participantes y los investigadores sirviendo como audiencia. El discurso se interrumpió a mitad de camino para las mediciones., La secuencia de los procedimientos en esta fase fue la siguiente: (a) sentarse en una silla dispuesta frente a otras personas; (b) elegir el tema del discurso; (c) pensar en el tema durante 1 minuto; (d) comenzar el discurso, que se interrumpió después de 1 minuto; (e) completar la escala de autoevaluación (factores de ansiedad y sedación VAMS) y las mediciones fisiológicas; (f) continuar el discurso durante otro minuto. Esta secuencia duró 5 min como máximo, de modo que, después de 1 h, todos los voluntarios habían pasado por el procedimiento. La fase final del estudio comenzó 216 min después de que el primer voluntario hubiera tomado el medicamento., Todas las mediciones se repitieron, manteniendo el intervalo de 5 minutos para cada voluntario. La tabla 1 presenta un esquema del procedimiento experimental.

la TABLA 1. Horario de la sesión experimental.
análisis estadístico
las características clínicas y demográficas se analizaron con pruebas no paramétricas (sexo) y análisis de varianza de un factor (ANOVA; edad, IMC y stai-trait).,
los puntajes en los dos factores del VAMS, presión arterial sistólica y diastólica, y frecuencia cardíaca se analizaron con un análisis de varianza de medidas repetidas (ANOVA de medidas repetidas) que incluyó los factores «fase», «grupos» e interacción fase-grupo. En los casos en que no se alcanzaron las condiciones de esfericidad, los grados de libertad del factor repetido se corrigieron con el EPSILON de Huynh-Feldt. Las comparaciones entre los grupos se hicieron en cada fase utilizando un ANOVA de un factor seguido de comparaciones múltiples con la prueba de Student-Newman-Keuls.,
el análisis de los datos se realizó utilizando el Statistical Package for the Social Sciences (SPSS) versión 17, y el nivel de significancia adoptado fue p < 0,05.
Resultados
Las características demográficas y clínicas de los sujetos se muestran en la Tabla 2. Los grupos no difirieron significativamente con respecto al sexo, la edad, el IMC y las puntuaciones del STAI-trait.

la TABLA 2. Características demográficas y clínicas de los grupos.,
El ANOVA de medidas repetidas de puntuaciones en el factor de ansiedad de los VAMS mostró un efecto significativo de la fase (F3,162 = 60.24; p<0.001), grupo (F4,54 = 3.25; p = 0.018), y la interacción fase-grupo (F12,162 = 3,79; p< 0,001, figura 1a). Las comparaciones Post hoc entre los grupos en cada fase mostraron diferencias significativas (p < 0.05) entre PLAC y CLON en las fases del habla y post-estrés., Las puntuaciones del grupo CBD-300 fueron significativamente diferentes de las del grupo CBD-900 en la fase del habla y de las de los grupos PLAC y CBD-100 durante la fase post-estrés (p < 0.05). Como ilustración, la figura 1B muestra la curva dosis-respuesta en forma de U invertida inducida por el CBD en la fase post-estrés. En cuanto al factor de sedación del VAMS, las medidas repetidas ANOVA mostraron efectos significativos de fase (F2,16, 116, 7 = 3.11; p = 0.028) y grupo (F4, 54 = 3.48; P = 0.013, figura 2a)., Una comparación post hoc general entre los grupos mostró que el clonazepam indujo un efecto sedante más alto en comparación con los otros grupos (efecto principal del tratamiento). Se observó un efecto similar en la fase post-estrés (p < 0,05).
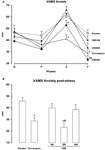
la FIGURA 1. Cambios en las puntuaciones del factor de ansiedad de la escala Visual analógica del Estado de ánimo (VAMS) (mm) inducidos por hablar en público en voluntarios sanos (A) durante la línea basal (B) y durante las fases pre-estrés (P), discurso (S) y post-estrés (F) (A)., En aras de la claridad, los resultados de la última fase (F) también se muestran como un gráfico de barras (B). Los puntos representan las medias ± SEM de 11-12 sujetos. Los asteriscos ( ∗ ) indican diferencias estadísticamente significativas en comparación con el grupo placebo, ( + ) indica una diferencia significativa en comparación con el grupo CBD-900, y (&) indica una diferencia significativa en comparación con el grupo CBD-100.
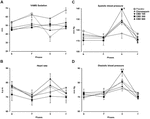
la FIGURA 2., Cambios en el factor de sedación del VAMS (mm, A), Frecuencia Cardíaca , presión arterial sistólica (C) y diastólica (D) (mm Hg) inducidos por hablar en público en voluntarios sanos. Los puntos representan las medias ± SEM de 11-12 sujetos. Los asteriscos ( ∗ ) indican diferencias estadísticamente significativas en comparación con los otros grupos, (&) indica una diferencia significativa en comparación con clonazepam, y (di) indica una diferencia significativa en comparación con el grupo CBD-100.,
discusión
utilizamos el TPSRS Para inducir experimentalmente la ansiedad e investigamos si el efecto ansiolítico del CBD en humanos produce una curva dosis-respuesta en forma de U invertida. En la línea de evidencia previa (Zuardi et al., 2013), este protocolo aumentó significativamente la ansiedad subjetiva, la presión arterial y la frecuencia cardíaca, como lo muestra el efecto significativo de la fase encontrada en un ANOVA de medidas repetidas., Además, el TPSRS fue sensible en la detección del efecto ansiolítico del clonazepam, un medicamento ansiolítico bien conocido, lo que sugiere que puede usarse para identificar medicamentos potencialmente ansiolíticos.
a la dosis de 300 mg, el CBD disminuyó significativamente la ansiedad subjetiva en comparación con el grupo PLAC durante la fase posterior al habla del protocolo. Sin embargo, lo mismo no fue cierto para una dosis más baja (100 mg) o más alta (900 mg) del medicamento., Además, las puntuaciones de ansiedad subjetiva del grupo CBD-300 también diferían significativamente de las del grupo CBD-900 durante la fase del habla, y del grupo CBD-100 durante la fase posterior al habla. Estos resultados sugieren que el efecto ansiolítico agudo del CBD siguió una curva dosis-respuesta en forma de U invertida, que es consistente con los resultados de estudios en animales (Guimarães et al., 1990; Levin et al., 2014; Nazario et al., 2015; Peres et al., 2016). Curiosamente, la misma dosis de CBD que produjo efectos ansiolíticos (300 mg) no redujo la sistólica y la pad como el clonazepam., Esta disociación entre los efectos ansiolíticos y simpatoinhibitorios después de la administración aguda de CBD es consistente con nuestras observaciones utilizando el SPST en voluntarios sanos (Zuardi et al., 1993) y en pacientes con fobia social (Bergamaschi et al., 2011a).
el mecanismo subyacente a este patrón de efecto dosis-respuesta del CBD aún no se puede explicar completamente. En los seres humanos, las áreas del cerebro límbico y paralímbico parecen estar involucradas en la acción ansiolítica del CBD., Por ejemplo, los estudios que utilizaron tomografía computarizada por emisión de fotón único (SPECT) en voluntarios sanos y pacientes sin tratamiento previo con SAD mostraron la participación de las mismas áreas implicadas en el efecto ansiolítico de CBD 400 mg, a saber, el giro parahippocampal izquierdo y el complejo amígdala-hipocampo izquierdo (Crippa et al., 2004, 2011). Usando imágenes de resonancia magnética funcional (fMRI) en voluntarios sanos, los investigadores encontraron que el CBD 600 mg atenuó la activación en la amígdala y la corteza cingulada anterior durante el reconocimiento de expresiones faciales temerosas (Fusar-Poli et al., 2009)., Los autores explicaron además que esta acción del CBD estaba mediada por alteraciones en la conectividad prefrontal subcortical a través de la amígdala y la corteza cingulada anterior (Fusar-Poli et al., 2010).
a pesar de la identificación de áreas cerebrales que pueden estar involucradas en el efecto ansiolítico del CBD, el mecanismo farmacológico específico responsable de este efecto aún no se ha dilucidado., El CBD es un fármaco con múltiples dianas farmacológicas, incluida la interacción con varios receptores (CB1, CB2, GPR55, TRPV1 y 5-HT1A), la interferencia con la captación y el metabolismo de los endocannabinoides y el aumento de la neurogénesis del hipocampo en el cerebro adulto (Zuardi et al., 2017). Varios estudios han apoyado la participación de los receptores 5-HT1A en la acción ansiolítica aguda del CBD., Por ejemplo, un antagonista del receptor 5-HT1A previene el efecto ansiolítico inducido por inyecciones sistémicas o intradormorales de CBD (DPAG) en ratas (Campos y Guimarães, 2008; Soares et al., 2010). Una interacción similar entre el CBD y los receptores 5-HT1A en otras estructuras cerebrales relacionadas con el control de comportamientos similares a la ansiedad, como el núcleo del lecho de la stria terminallis o la corteza frontal preliminar, también está involucrada en la atenuación de las respuestas de ansiedad (Gomes et al., 2011, 2012; Fogaça et al., 2014)., En células cultivadas, se ha informado que el CBD actúa como un agonista del receptor 5-HT1A (Russo et al., 2005), aunque estudios recientes sugieren que este no es el caso en cortes o condiciones in vivo. La facilitación de la neurotransmisión mediada por 5-HT1A por el CBD no parece implicar el bloqueo de la recaptación de 5-HT o cambios en la expresión de 5-HT1A mRNA en el DPAG después de la administración crónica de CBD (Campos et al., 2013). Estas observaciones sugieren que la modulación de los receptores 5-HT1A por el CBD es compleja y podría involucrar interacciones alostéricas(Rock et al., 2011).,
como se mencionó anteriormente, los mecanismos responsables de la curva dosis-respuesta en forma de U invertida del CBD son poco conocidos. Podrían implicar interacciones con el receptor vaniloide 1 o TRPV1. A altas concentraciones, el CBD puede activar estos receptores y facilitar la liberación de glutamato y las respuestas defensivas(Guimarães et al., 1991; Campos y Guimarães, 2009). Este mecanismo podría enmascarar el efecto ansiolítico del CBD mediado por los receptores 5-HT1A., Al probar esta posibilidad con inyecciones intra-DPAG en ratas, Campos y Guimarães (2009) mostraron que el pretratamiento con un antagonista del TRPV1 (capsazepina) convirtió una dosis más alta e ineficaz de CBD en una ansiolítica. Queda por probar si un mecanismo similar también está involucrado en la curva dosis-respuesta en forma de U observada en nuestro estudio. En consonancia con la evidencia previa que indica que el CBD tiene propiedades sedantes más débiles en comparación con las benzodiacepinas (Zuardi et al., 1993), la dosis ansiolítica de CBD (300 mg) indujo un nivel de sedación significativamente menor que el clonazepam., Es una ventaja que debe destacarse, ya que la sedación y el deterioro de la coordinación motora se encuentran entre los efectos adversos más comunes de las benzodiacepinas, además de la posible dependencia, déficits cognitivos y síntomas de abstinencia, especialmente en la vejez (Sgnaolin et al., 2016). Estos efectos secundarios no se han observado con el uso de CBD (Bergamaschi et al., 2011b).
los hallazgos reportados aquí deben ser interpretados con cautela, dadas las limitaciones de nuestro estudio., En primer lugar, habría sido deseable medir los niveles plasmáticos de CBD y clonazepam y relacionar estas mediciones con la magnitud de los niveles de ansiedad; sin una curva dosis-respuesta, quedan dudas sobre si los efectos del CBD realmente siguen una curva en forma de U invertida. Cabe señalar, sin embargo, que las investigaciones anteriores no han sido capaces de establecer una relación directa entre los niveles plasmáticos de CBD y sus efectos clínicos (Agurell et al., 1986). Además, el pequeño tamaño de la muestra limita el poder estadístico del ensayo., Además, el diseño del estudio no nos permite descartar la posibilidad de que otra dosis moderada (por ejemplo, 400 o 600 mg) podría haber tenido efectos ansiolíticos aún mayores. Por ejemplo, estudios previos han demostrado efectos ansiolíticos agudos de 400 mg de CBD En estudios SPECT en voluntarios sanos(Crippa et al., 2004) y en pacientes con fobia social (Crippa et al., 2011) y de CBD 600 mg en un experimento de IRMf con hombres sanos (Bhattacharyya et al., 2010)., Aunque no es necesario para este estudio de prueba de concepto, estas limitaciones podrían ser superadas en futuros estudios que examinen otras 2-3 dosis entre 300 y 900 mg para establecer un verdadero índice terapéutico.
conclusión
nuestros resultados están en consonancia con la evidencia de estudios preclínicos y apoyan la opinión de que el CBD induce efectos ansiolíticos agudos con una curva dosis-respuesta en forma de U invertida en humanos. Estos hallazgos enfatizan la importancia de la elección cuidadosa de los rangos de dosis al investigar los posibles efectos terapéuticos del CBD., Otros estudios que evalúen la curva dosis-respuesta del CBD En otras afecciones como la esquizofrenia, el dolor, la epilepsia y la enfermedad de Parkinson y que involucren la administración crónica de CBD son necesarios para traducir las evidencias preclínicas en la práctica clínica y determinar la ventana terapéutica precisa del CBD para cada afección.
contribuciones de los autores
AZ, JH y JC diseñaron el estudio. NR, AS y SB realizaron los experimentos. AZ y FG realizaron el análisis estadístico. AZ escribió el primer borrador del manuscrito., Todos los autores contribuyeron y aprobaron el manuscrito final.
Declaración de conflicto de intereses
AZ, JH, FG y JC son co-inventores (Mechoulam R, JC, Guimaraes FS, az, JH, Breuer a) de la patente «Fluorinated CBD compounds, compositions and uses thereof. Pub. No.: WO/2014/108899. La Solicitud Internacional No.: PCT/IL2014 / 050023 » Def. Nosotros no. Reg. 62193296; 29/07/2015; INPI el 19/08/2015 (BR1120150164927). La Universidad de São Paulo ha licenciado la patente a Phytecs Pharm (resolución USP no. 15.1.130002.1.1)., La Universidad de São Paulo tiene un acuerdo con Prati-Donaduzzi (Toledo, Brasil) para » desarrollar un producto farmacéutico que contenga cannabidiol sintético y demostrar su seguridad y eficacia terapéutica en el tratamiento de la epilepsia, la esquizofrenia, la enfermedad de Parkinson y los trastornos de ansiedad.»JH y JC han recibido apoyo de viaje de BSPG-Pharm.
los demás autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.,
los revisores RWG, KA y handling Editor declararon su afiliación compartida, y el editor handling afirma que el proceso, sin embargo, cumplió con los estándares de una revisión justa y objetiva.
agradecimientos
AZ, JH, FG y JC reciben el premio fellowship del Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, Brasil). El presente estudio fue apoyado por una subvención del CNPq (CNPq / MS/SCTIE / DECIT N 2 26/2014 – Pesquisas sobre Distúrbios Neuropsiquiátricos; 466805/2014-4) y BSPG-Pharm (Sandwich, Reino Unido) ha suministrado CBD sin costo alguno.,
Campos, A.C., and Guimarães, F. S. (2008). Implicación de los receptores 5HT1A en los efectos ansiolíticos del cannabidiol inyectado en el gris periacueductal dorsolateral de ratas. Psychopharmacology (Berl) 199, 223-230. doi: 10.1007 / s00213-008-1168-x
PubMed Abstract / CrossRef Full Text / Google Scholar
Campos, A.C., and Guimarães, F. S. (2009). Evidencia de un papel potencial de los receptores TRPV1 en el gris periacueductal dorsolateral en la atenuación de los efectos ansiolíticos de los cannabinoides. Prog., Neuropsychopharmacol. Biol. Psychiatry 33, 1517–1521. doi: 10.1016/j.pnpbp.2009.08.017
PubMed Abstract | CrossRef Full Text | Google Scholar