10.2 Brønsted-Lowry definición de ácidos y Bases
objetivos de aprendizaje
- Reconocer un compuesto como un ácido de Brønsted-Lowry o una base de Brønsted-Lowry.
- ilustran el proceso de transferencia de protones que define una reacción ácido-base de Brønsted-Lowry.
El amoníaco (NH3) aumenta la concentración de iones hidróxido en solución acuosa reaccionando con agua en lugar de liberar iones hidróxido directamente., De hecho, las definiciones de Arrhenius de un ácido y una base se centran en iones de hidrógeno e iones de hidróxido. ¿Hay definiciones más fundamentales para ácidos y bases?
en 1923, el científico danés Johannes Brønsted y el científico inglés Thomas Lowry propusieron de forma independiente nuevas definiciones para ácidos y bases. En lugar de considerar los iones de hidrógeno e hidróxido, se centraron solo en el ion hidrógeno. Un compuesto Brønsted-Lowry acidA que suministra un ion hidrógeno (H+) en una reacción; un donante de protones. es un compuesto que suministra un ion hidrógeno en una reacción., Compuesto de Brønsted-Lowry baseA que acepta un ion hidrógeno (H+) en una reacción; un aceptor de protones., por el contrario, es un compuesto que acepta un ion hidrógeno en una reacción. Por lo tanto, las definiciones de Brønsted-Lowry de un ácido y una base se centran en el movimiento de iones de hidrógeno en una reacción, en lugar de en la producción de iones de hidrógeno e iones de hidróxido en una solución acuosa.
usemos la reacción del amoníaco en el agua para demostrar las definiciones de Brønsted-Lowry de un ácido y una base., El amoníaco y las moléculas de agua son reactivos, mientras que el ion amonio y el ion hidróxido son productos:
NH3(aq) + H2O ( → ) → NH4+(AQ) + OH−(AQ)
lo que ha sucedido en esta reacción es que la molécula de agua original ha donado un ion hidrógeno a la molécula de amoníaco original, que a su vez ha aceptado el ion hidrógeno. Podemos ilustrar esto de la siguiente manera:
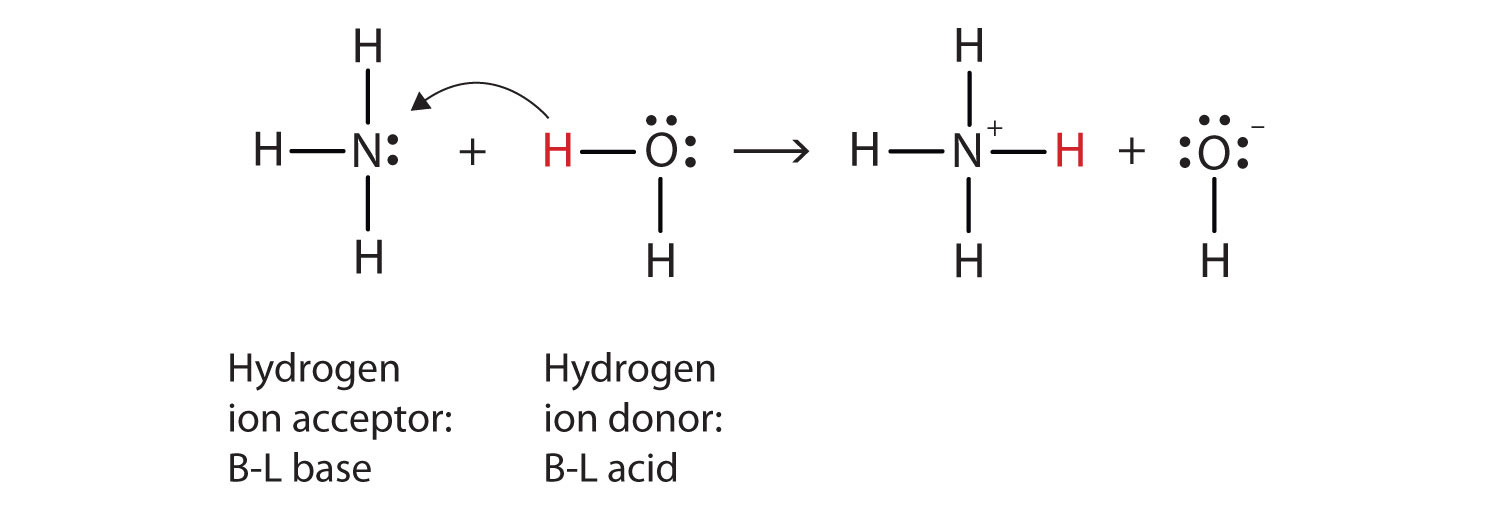
debido a que la molécula de agua dona un ion de hidrógeno al amoníaco, es el ácido de Brønsted-Lowry, mientras que la molécula de amoníaco—que acepta el ion de hidrógeno—es la base de Brønsted-Lowry., Por lo tanto, el amoníaco actúa como una base tanto en el sentido de Arrhenius como en el sentido de Brønsted-Lowry.
¿es un ácido Arrhenius como el ácido clorhídrico todavía un ácido en el sentido de Brønsted-Lowry? Sí, pero requiere que entendamos lo que realmente sucede cuando el HCl se disuelve en agua. Recordemos que el átomo de hidrógeno es un solo protón rodeado por un solo electrón. Para hacer el ion hidrógeno, eliminamos el electrón, dejando un protón Desnudo. ¿Realmente tenemos protones desnudos flotando en solución acuosa? No, No lo hacemos., Lo que realmente sucede es que el ion H+ se adhiere al H2O para hacer H3O+, que se llama ion hidronio. Para la mayoría de los propósitos, H+ y H3O+ representan la misma especie, pero escribir H3O+ en lugar de H+ muestra que entendemos que no hay protones desnudos flotando alrededor en solución. Más bien, estos protones están realmente Unidos a moléculas solventes.
Nota
un protón en solución acuosa puede estar rodeado por más de una molécula de agua, dando lugar a fórmulas como H5O2 + o H9O4 + en lugar de H3O+. Sin embargo, es más sencillo utilizar H3O+.,
Con esto en mente, ¿cómo definimos el HCl como un ácido en el sentido de Brønsted-Lowry? Considere lo que sucede cuando el HCl se disuelve en H2O:
HCl + H2O ( → ) → H3O+(aq) + Cl−(aq)
podemos representar este proceso usando diagramas de puntos de electrones de Lewis:
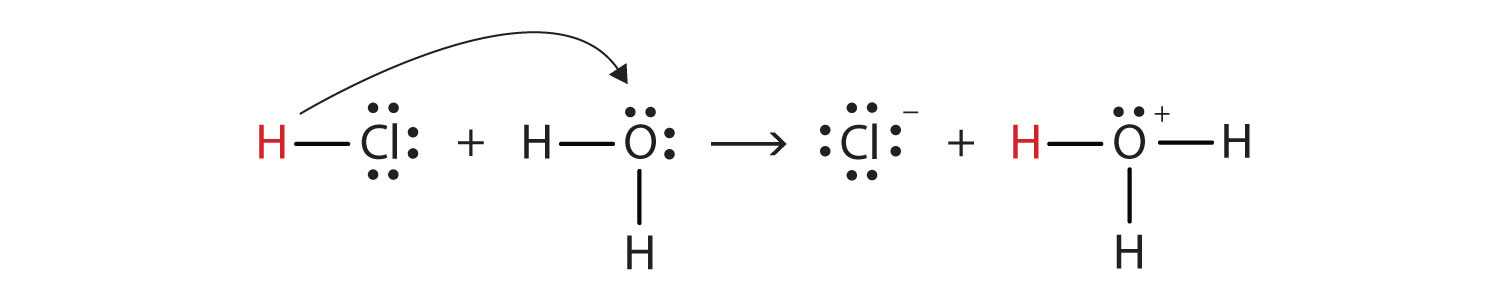
ahora vemos que un ion de hidrógeno se transfiere de la molécula de HCl a la molécula de H2O para producir iones cloruro e iones hidronio. Como donante de iones de hidrógeno, el HCl actúa como un ácido de Brønsted-Lowry; como aceptor de iones de hidrógeno, H2O es una base de Brønsted-Lowry., Por lo tanto, el HCl es un ácido no solo en el sentido de Arrhenius, sino también en el sentido de Brønsted-Lowry. Además, según las definiciones de Brønsted-Lowry, el H2O es una base en la formación de HCl acuoso. Por lo tanto, las definiciones de Brønsted-Lowry de un ácido y una base clasifican la disolución de HCl en agua como una reacción entre un ácido y una base, aunque la definición de Arrhenius no habría etiquetado a H2O como una base en esta circunstancia.
Nota
todos los ácidos y bases de Arrhenius también son ácidos y bases Brønsted-Lowry. Pero no todos los ácidos y bases de Brønsted-Lowry son ácidos y bases de Arrhenius.,
Ejemplo 3
la anilina (C6H5NH2) es ligeramente soluble en agua. Tiene un átomo de nitrógeno que puede aceptar un ion de hidrógeno de una molécula de agua al igual que el átomo de nitrógeno en el amoníaco. Escriba la ecuación química para esta reacción e identifique el ácido y la base de Brønsted-Lowry.
Solución
C6H5NH2 y H2O son los reactantes. Cuando C6H5NH2 acepta un protón de H2O, gana un H extra y una carga positiva y deja un ion OH detrás., La reacción es la siguiente:
C6H5NH2(aq) + H2O ( → ) → c6h5nh3+(AQ) + OH−(AQ)
debido a que C6H5NH2 acepta un protón, es la base de Brønsted-Lowry. La molécula H2O, debido a que dona un protón, es el ácido de Brønsted-Lowry.
ejercicio de desarrollo de habilidades
-
La cafeína (C8H10N4O2) es un estimulante que se encuentra en los cafés y tés. Cuando se disuelve en agua, puede aceptar un protón de una molécula de agua. Escriba la ecuación química para este proceso e identifique el ácido y la base de Brønsted-Lowry.,
Las definiciones de Brønsted-Lowry de un ácido y una base se pueden aplicar a las reacciones químicas que ocurren en disolventes distintos del agua. El siguiente ejemplo ilustra.
Ejemplo 4
la amida de sodio (NaNH2) se disuelve en metanol (CH3OH) y se separa en iones de sodio e iones de amida (NH2−). Los iones amida reaccionan con el metanol para producir amoníaco y el ion metóxido (CH3O−). Escriba una ecuación química equilibrada para este proceso e identifique el ácido y la base de Brønsted-Lowry.,
solución
La ecuación para la reacción es entre NH2− y CH3OH para hacer NH3 y CH3O− es la siguiente:
NH2−(solv) + CH3OH ( → ) → NH3(solv) + CH3O−(solv)
la etiqueta (solv) indica que las especies están disueltas en algún disolvente, en contraste con (aq), que especifica una solución acuosa (H2O). En esta reacción, vemos que el ion NH2 acepta un protón de una molécula de CH3OH para hacer una molécula de NH3. Así, como el aceptor de protones, NH2-es la base de Brønsted-Lowry. Como donante de protones, el CH3OH es el ácido de Brønsted-Lowry.,
ejercicio de desarrollo de habilidades
-
El cloruro de piridinio (C5H5NHCl) se disuelve en etanol (C2H5OH) y se separa en iones de piridinio (C5H5NH+) e iones de cloruro. El ion piridinio puede transferir un ion hidrógeno a una molécula solvente. Escriba una ecuación química equilibrada para este proceso e identifique el ácido y la base de Brønsted-Lowry.
para su salud: reacciones ácido-base de Brønsted-Lowry en productos farmacéuticos
hay muchas aplicaciones interesantes de las reacciones ácido-base de Brønsted-Lowry en la industria farmacéutica., Por ejemplo, los medicamentos a menudo deben ser solubles en agua para obtener la máxima eficacia. Sin embargo, muchos compuestos orgánicos complejos no son solubles o solo son ligeramente solubles en agua. Afortunadamente, aquellos medicamentos que contienen átomos de nitrógeno que aceptan protones (y hay muchos de ellos) pueden reaccionar con ácido clorhídrico diluido . Los átomos de nitrógeno—que actúan como bases de Brønsted-Lowry—aceptan los iones de hidrógeno del ácido para formar un ion, que suele ser mucho más soluble en agua., Las moléculas modificadas del fármaco pueden aislarse como sales de cloruro:
RN (sl aq) + h+(AQ) → RNH+(AQ) →Cl−(aq) rnhcl(S)
donde RN representa algún compuesto orgánico que contiene nitrógeno. La etiqueta (sl aq) significa «ligeramente acuoso», lo que indica que el compuesto RN es sólo ligeramente soluble. Los medicamentos que se modifican de esta manera se llaman sales de clorhidrato. Los ejemplos incluyen el analgésico potente codeína, que se administra comúnmente como clorhidrato de codeína. También se utilizan ácidos distintos del ácido clorhídrico. El ácido hidrobromático, por ejemplo, da sales de hidrobromuro., El dextrometorfano, un ingrediente de muchos medicamentos para la tos, se administra como bromhidrato de dextrometorfano. La figura adjunta muestra otro medicamento como una sal de clorhidrato.
El nombre de este medicamento deja en claro que existe como la sal de hidrocloruro.
© Thinkstock
Revisión del Concepto de Ejercicio
-
Dar la definición de Brønsted-Lowry ácido y una de Brønsted-Lowry base.,
respuesta
-
un ácido de Brønsted-Lowry es un donante de protones, mientras que una base de Brønsted-Lowry es un aceptor de protones.
conclusiones clave
- Un ácido de Brønsted-Lowry es un donante de protones, y una base de Brønsted-Lowry es un aceptor de protones.
- Las reacciones ácido-base de Brønsted-Lowry son esencialmente reacciones de transferencia de protones.
ejercicios
-
etiqueta cada reactivo como un ácido de Brønsted-Lowry o una base de Brønsted-Lowry.,
HCl ( aq) + NH3(AQ) → NH4 + (AQ) + Cl−(AQ)
-
etiqueta cada reactivo como un ácido de Brønsted-Lowry o una base de Brønsted-Lowry.
H2O (ℓ) + N2H4(AQ) → N2H5 + (AQ) + OH−(AQ)
-
explique por qué un ácido de Brønsted-Lowry puede llamarse donante de protones.
-
explicar por qué una base de Brønsted-Lowry puede ser llamada aceptor de protones.
-
escriba la ecuación química de la reacción de amoníaco en agua y etiquete el ácido y la base de Brønsted-Lowry.,
-
escriba la ecuación química de la reacción de metilamina (CH3NH2) en agua y etiquete el ácido y la base de Brønsted-Lowry.
-
demostrar que la disolución de HNO3 en agua es en realidad una reacción ácido-base de Brønsted-Lowry describiéndola con una ecuación química y etiquetando el ácido y la base de Brønsted-Lowry.,
-
identifique el ácido y la base de Brønsted-Lowry en la siguiente ecuación química:
c3h7nh2(aq) + H3O+(aq) → c3h7nh3+(aq) + H2O(ℓ)
-
escriba la ecuación química para la reacción que ocurre cuando el clorhidrato de cocaína (c17h22clno4) se disuelve en agua y dona un protón a una molécula de agua. (Cuando los clorhidratos se disuelven en agua, se separan en iones cloruro y el catión apropiado.)
-
si el hidrobromuro de codeína tiene la fórmula c18h22brno3, ¿Cuál es la fórmula del compuesto padre codeína?,