Richard Baxter og Jim Britton
Hvordan virker stål korroderer i vand?
for at forstå katodisk beskyttelse skal du først forstå, hvordan korrosion er forårsaget. For at korrosion skal forekomme, skal der være tre ting:
1. To forskellige metaller
2. En elektrolyt (vand med enhver form for salt eller salte opløst i det)
3., Et metal (ledende) sti mellem den uens metaller
De to ulige metaller kan være helt forskellige legeringer, såsom stål og aluminium – men er mere tilbøjelige til at være mikroskopisk eller makroskopisk metallurgiske forskelle på overfladen af et enkelt stykke stål. I dette tilfælde vil vi overveje frit korroderende stål, hvilket er ikke-ensartet.
Hvis ovenstående betingelser findes, finder følgende reaktion sted på de mere aktive steder: (to jernioner plus fire frie elektroner).,
2Fe => 2Fe++ + 4e-
Den frie elektroner rejse gennem metal vej til den mindre aktive steder, hvor følgende reaktion finder sted: (ilt gassen omdannes til ilt-ion – ved at kombinere med de fire frie elektroner – som kombinerer det med vand og danner hydroxyl ioner).
O2 + 4e- + 2H20 => 4 OH-
Recombinations af disse ioner i den aktive overflade producere følgende reaktion, som giver jern-rust produkt, jern-hydroxid: (jern kombinere med ilt og vand til at danne jern-hydroxid).,
2Fe + O2 + 2H2O => 2Fe (OH)2
Denne reaktion er mere almindeligt beskrevet som ” strøm gennem vandet fra anoden (mere aktive site) til katoden (mindre aktive site).’
Hvordan stopper katodisk beskyttelse korrosion?
katodisk beskyttelse forhindrer korrosion ved at omdanne alle de anodiske (aktive) steder på metaloverfladen til katodiske (passive) steder ved at levere elektrisk strøm (eller frie elektroner) fra en alternativ kilde.
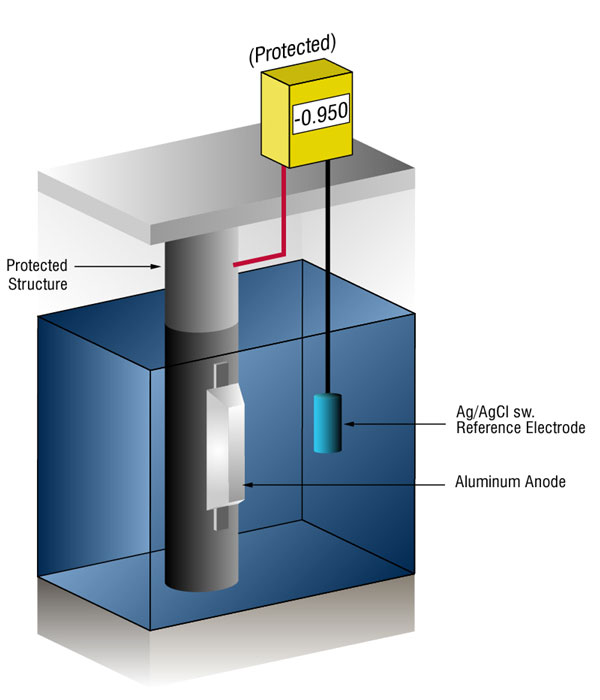
normalt har dette form af galvaniske anoder, som er mere aktive end stål., Denne praksis kaldes også et offersystem, da de galvaniske anoder ofrer sig for at beskytte det strukturelle stål eller rørledning mod korrosion.
I tilfælde af aluminium anoder, reaktionen på aluminium overflade: (fire aluminium ioner plus tolv frie elektroner)
4Al => 4AL+++ + 12 e-
og på stål overflade: (ilt gas omdannes til ilt-ioner, som kombinerer med vand og danner hydroxyl ioner).,3O2 + 12e – + 6H20 => 12OH –
så længe strømmen (frie elektroner) ankommer til katoden (stål) hurtigere end ilt ankommer, vil der ikke forekomme korrosion.,
Grundlæggende overvejelser, når designe sacrificial anode systemer
Den elektriske strøm, en anode udledninger er kontrolleret af Ohm ‘ s lov, som er:
I=E/R
I= strøm i ampere
E= Forskel i potentiale mellem anode og katode i volt
R= det Samlede kredsløb modstand i ohm
i første omgang, nuværende vil være høj, fordi forskellen i potentialet mellem anode og katode er høj, men som den potentielle forskel mindskes på grund af effekten af den nuværende flow på katoden, den nuværende aftager gradvist på grund af polariseringen af katoden., Kredsløbsmodstanden inkluderer både vandstien og metalbanen, som inkluderer ethvert kabel i kredsløbet. Den dominerende værdi her er modstanden af anoden til havvandet.
for de fleste applikationer er metalmodstanden så lille sammenlignet med vandmodstanden, at den kan ignoreres (selvom dette ikke gælder for slæder eller lange rørledninger, der er beskyttet mod begge ender). Generelt har lange, tynde anoder lavere modstand end korte, fede anoder. De vil aflade mere strøm, men vil ikke vare så længe.,
derfor skal en katodisk beskyttelsesdesigner dimensionere anoderne, så de har den rigtige form og overfladeareal til at aflade tilstrækkelig strøm til at beskytte strukturen og tilstrækkelig vægt til at vare den ønskede levetid, når denne strøm aflades.
som en generel tommelfingerregel:
anodens længde bestemmer, hvor meget strøm anoden kan producere, og følgelig hvor mange kvadratmeter stål der kan beskyttes. Tværsnittet (vægt) bestemmer, hvor længe anoden kan opretholde dette beskyttelsesniveau.,
Imponeret-current katodisk beskyttelse systemer (ICCP anode-systemer)
på Grund af den høje strømme involveret i mange havvand systemer, er det ikke ualmindeligt at bruge imponeret-current-systemer, der bruger anoder af en type (ICCP anoder), der er ikke let opløses i metalioner. Dette medfører en alternativ reaktion: o .idationen af de opløste chloridioner.
2Cl – => Cl2 + 2e-
strøm leveres af en ekstern JÆVNSTRØMSENHED.,figur 2: Impressed-current cathodic-protection system in seawaterater 
Hvordan ved vi, hvornår vi har nok katodisk beskyttelse?
Vi kan kontrollere, at der er nok strøm ved at måle stålets potentiale mod en standardreferenceelektrode, normalt sølv sølv/chlorid (Ag/AgCl s..), men nogle gange zink (s..).
strømstrøm på ethvert metal vil skifte dets normale potentiale i negativ retning. Historien har vist, at hvis stål modtager nok strøm til at flytte potentialet til ( – ) 0.800 V vs., silver / silver chloride (Ag / AgCl), the corrosion is essentially stopped.
 |
 |