undersøgelse af kinetik kan forskerne til at bestemme forholdet mellem ændringer i betingelser og hastigheden af et bestemt kemisk reaktion. En af de vigtigste faktorer, der påvirker hastigheden af en reaktion er reaktiviteten af kemikalier involveret i den specifikke reaktion; desuden er der flere variabler, der også kan påvirke hastigheden af en reaktion (koncentration, temperatur, katalysator, etc.).
en af disse variabler anses for at være en kollision.,
hver kemisk reaktion kræver kollisioner mellem reaktantpartiklerne (atomer og / eller molekyler). På den anden side fremmer ikke alle kollisioner reaktionen, der finder sted. I stedet, hvis de kolliderende partikler ikke har tilstrækkelig kinetisk energi eller korrekt orientering i rummet, vil reaktionen ikke forekomme.
men hvad menes med “tilstrækkelig energi” eller “korrekt orientering”? For at få en bedre ide om de tidligere nævnte begreber, vil artiklen give nogle generelle definitioner ledsaget af tilsvarende eksempler og prøveproblemer.,
vores hovedmål er at definere begrebet aktiveringsenergi og forklare, hvorfor nogle af kollisionerne ikke resulterer i en reaktion.
derfor vil denne artikel primært fokusere på begrebet reaktiv kollision. Sammen med det vil vi kort gennemgå nogle scenarier, der involverer ikke-reaktive kollisioner. Da kollisioner er forbundet med to hovedkarakteristika, energi og rumlig orientering, vil vi også diskutere disse udtryk.,
Kollisionsteori
Som vi allerede har nævnt ovenfor, skal kollisioner mellem to eller flere molekyler forekomme for at en kemisk reaktion kan finde sted. Men kollision er ikke nok til, at reaktanterne omdannes til produkter. Molekyler skal have nok energi, og de skal kollidere med den korrekte rumlige orientering.
som du måske allerede ved, er der forskellige typer reaktioner, herunder syntese, nedbrydning, forskydning og forbrænding., I betragtning af den kendsgerning, at kollision teori fokuserer på de reaktioner, som involverer sammenstød mellem to arter, behøver du ikke at bekymre sig meget om nedbrydning reaktioner, da der i sådanne tilfælde, et enkelt stof er faldet fra hinanden, og der er ingen grund til at overveje, kollisioner eller orientering af partikler i rummet.
i tilfælde af reaktioner, der involverer to arter, er kollisioner mellem molekylerne afgørende for reaktionen at fortsætte; men kun kollisioner af molekyler med tilstrækkelig kinetisk energi og relevant rumlig orientering kan forårsage en reaktion., Således er energi nødvendig for at bryde bindingerne inden for de reagerende molekyler, mens orienteringen af molekyler i rummet spiller en vigtig rolle i foring af rigtige atomer med hinanden for at reformere de ødelagte bindinger på den rigtige måde.
når begge kriterier er opfyldt, betragtes kollisionen som en vellykket, effektiv eller reaktiv kollision.
i betragtning af vigtigheden af de to faktorer, der er nævnt ovenfor (energi og orientering), bør vi fortsætte den yderligere forklaring af udtrykkene og begreberne for bedre at forstå principperne for kollisionsteori.,
aktiveringsenergi
som vi allerede nævnte tidligere, skal partikler kollidere med tilstrækkelig energi til, at en reaktion kan forekomme. Denne minimale energi, der kræves for at reaktionen kan fortsætte, defineres som aktiveringsenergien.,
Som du måske ved, er der to typer af reaktioner om frigørelse af energi eller absorption, som er følgende:
- Endoterm reaktion – energi, der absorberes i en reaktion (som regel i form af varme)
- Eksoterm reaktion – energi er udgivet i en reaktion (som regel i form af varme)
Ved første øjekast, det kan synes, at, da energien frigives på en eksoterm reaktion, bør der ikke være noget behov for at indtaste noget energi for reaktionen opstår. Tværtimod kræver begge endoterme og eksoterme kemiske reaktioner energi for at komme i gang.,
det virker lidt underligt, ikke? Hvorfor har en reaktion brug for input af energi, hvis energien derfor frigives?
lad os overveje følgende eksempler på eksoterme reaktioner, der forekommer i vores hverdag.

Eksempel #1 – Afbrænding af Stearinlys
afbrænding af stearinlys frigiver energi i form af varme, og derfor er den reaktion, der opstår i løbet af processen er exoterm. Det er klart, at du skal tænde lyset ved hjælp af en kamp eller lighter., Hvad dette betyder er, at du er nødt til at indtaste noget energi for lyset at lyse op. Derefter har reaktionen tilstrækkelig energi til at gå videre til de næste trin, og lyset fortsætter med at brænde energi.
et stearinlys vil dog aldrig briste i flammer alene, ikke?
Eksempel #2 – Belysning en Match

En typisk kamp hoved består af svovl, der er blandet med forskellige oxidationsmidler. For at antænde tændstikken skal du gnide kamphovedet mod den specielle side af en tændstikboks., Under denne proces finder en reaktion sted og frigiver energi i former for lys og varme. Reaktionen anses således for at være eksoterm. Selvom, du stadig nødt til at indtaste nogle energi til tændstik til at begynde at brænde. Denne energi defineres via udtrykket ” aktiveringsenergi.”På samme måde som det foregående eksempel, så længe du giver tilstrækkelig energi til, at tændstikken lyser, vil den fortsætte med at brænde og frigive varme alene. Aktiveringsenergigraf viser de energiændringer, der opstår under en kemisk reaktion.,
for At plotte aktivering energi graf, er det af afgørende betydning at overveje to variabler:
- Antallet af sammenstød mellem forskellige molekyler
- Kinetisk energi af de kolliderende molekyler
Den første variabel er ganske let at forstå, da det har direkte betydning – det definerer antallet af kollisioner mellem partikler af to arter per sekund. den anden variabel er den kinetiske energi af de kolliderende molekyler, som kan defineres som energien i molekylernes bevægelse.
- endoterm reaktion – energi absorberes., Reaktanternes energi er lavere end produktets energi.
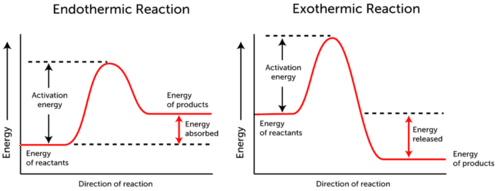
- Eksoterm Reaktion – energi er udsendt. Reaktanternes energi er mere end produktets energi.
som du kan se i de to grafer ovenfor, er aktiveringsenergi for begge, endoterme og eksoterme reaktioner den samme.,da endoterm reaktion ikke kan producere så meget energi, som den skal forbruge for at reaktionen kan forekomme, absorberes energien; derfor er produktets energi højere end reaktanternes energi.tværtimod producerer eksoterme reaktioner mere energi, end de bruger som aktiveringsenergi. Som følge heraf frigives energien, og produkterne har lavere energi end reaktanterne.,
som en konklusion kan det siges, at selvom reaktantmolekyler hurtigt kolliderer med hinanden, er det vigtigt, at molekylerne har tilstrækkelig energi til, at reaktionen kan forekomme.
rumlig orientering
ifølge kollisionsteorien er ikke alle kollisioner vellykkede, selvom reaktantmolekylerne har tilstrækkelig aktiveringsenergi. Molekylerne skal også kollidere den rigtige vej rundt.
Så, det andet aspekt, der påvirker reaktive kollisioner anses for at være rumlig orientering (orientering af molekyler i rummet).,
hvad menes med den “rigtige” orientering af molekyler i en reaktion?
Når to molekyler kolliderer, skal begge molekyler være placeret på den måde, at det er let for dem at reagere. For fuldt ud at forstå konceptet er det vigtigt at fremhæve reaktionsmekanismen.
Lad os se på reaktionen mellem propylen (eller propen) og hydrogenbromid som et eksempel:

Som du kan se ovenfor, er reaktionen forløber i 2 trin.,
Trin 1: dobbeltbindingen brydes
Trin 2: brom er vedhæftet
I denne reaktion, molekylær retningslinjer for HBr og C3H6 spiller en vigtig rolle, eftersom det er en af dem var beliggende i en anden måde, det ville ikke have været muligt for H-atom tilgang propylen molekyle.
dette gælder for enhver reaktion. Hvert molekyle skal have den rette orientering i rummet for at reaktionen kan finde sted. Korrekt orientering sikrer, at molekylerne er placeret på den måde, at det er relativt let for dem at kollidere og reagere.,
Vi kan konkludere, at den gunstige orientering af reaktantmolekyler er lige så vigtig som tilstrækkelig aktiveringsenergi.
Oversigt
Termer og begreber, der er defineret i hele den artikel er sammenfattet i tabellen nedenfor:
| Kollision Teorien | Forklarer, hvordan de partikler, der skal interagere eller med hinanden for at forårsage en reaktion., Ifølge Kollisionsteorien skal to kriterier være opfyldt for at en kemisk reaktion kan finde sted: molekyler skal kollidere med tilstrækkelig aktiveringsenergi til at bryde og omdanne eksisterende bindinger; molekyler skal kollidere med gunstig rumlig orientering. |
| Vellykket Kollision (også benævnt effektiv, eller reaktive kollision) | En kollision af molekyler med tilstrækkelig aktivering energi og ordentlig orientering i rummet, der resulterer i en kemisk reaktion., |
| aktiveringsenergi | den mindste energi, der kræves for at reaktionen kan forekomme. Tilførslen af energi er nødvendig i tilfælde af endoterme såvel som eksoterme reaktioner. |
| endoterm reaktion | energi (varme) absorberes; reaktanternes energi er lavere end produktets energi; kan ikke producere så meget energi, som den bruger under reaktionen., |
| eksoterm reaktion | energi (varme) frigives; reaktanternes energi er højere end produktets energi; kan producere mere energi, end den forbruger under reaktionen. |
| molekylær orientering | rumlig orientering af molekyler., |
Three different scenarios are represented in the picture attached below:
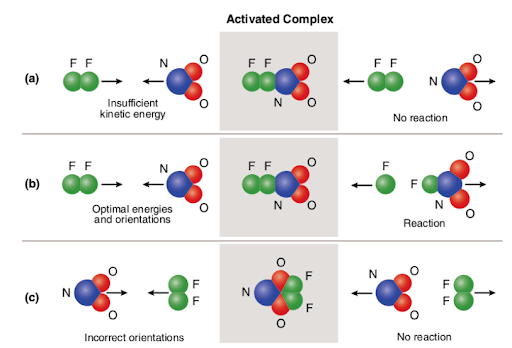
The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride.,
i tilfælde af (A) har reaktantmolekylerne korrekt rumlig orientering, men har ikke tilstrækkelig aktiveringsenergi; derfor forekommer reaktionen ikke på grund af det faktum, at der ikke er nok energi til at bryde bindinger. Så kollisionen mellem de to molekyler anses for at være ikke-reaktiv.
i tilfælde af (B) har reaktantmolekylerne både tilstrækkelig aktiveringsenergi og korrekt orientering i rummet. På grund af molekylernes optimale egenskaber fortsætter reaktionen, og nitrogeno .yfluorid dannes., Så kollisionen mellem de to molekyler anses for at være reaktiv.
i tilfælde af (c) har reaktantmolekylerne tilstrækkelig aktiveringsenergi, men er ikke korrekt placeret i rummet; derfor finder reaktionen ikke sted, da det ikke er muligt for molekylerne at nå hinanden på den måde, der bryder bindinger. På samme måde som det første tilfælde anses kollisionen mellem de to molekyler for at være ikke-reaktiv.