læringsmål
- til At få en forståelse af kollision teori.
- for at få en forståelse af de fire vigtigste faktorer, der påvirker reaktionshastigheden.
reaktionskinetik er undersøgelsen af hastigheden af kemiske reaktioner, og reaktionshastigheder kan variere meget over en lang række tidsskalaer. Nogle reaktioner kan fortsætte med eksplosivt hurtige hastigheder som detonering af fyrværkeri (figur 17.,1 “fyrværkeri om natten over floden”), mens andre kan forekomme med en træg hastighed over mange år som rustning af pigtråd udsat for elementerne (figur 17.2″rustet pigtråd”).figur 17.1. Fyrværkeri om natten over floden

den kemiske reaktion i fyrværkeri sker med en eksplosiv hastighed.
figur 17.2. Rustet pigtråd

rustning af pigtråd forekommer over mange år.,
Kollisionsteori
for at forstå kinetikken af kemiske reaktioner og de faktorer, der påvirker kinetikken, bør vi først undersøge, hvad der sker under en reaktion på molekylært niveau. Ifølge kollisionsteorien om reaktivitet forekommer reaktioner, når reaktantmolekyler “effektivt kolliderer.”For en “effektiv sammenstød” med at opstå, molekyler skal være orienteret i rummet korrekt, for at lette brud og dannelse af obligationer og omlægning af atomer, der resulterer i dannelsen af produkt-molekyler (Figur 17.3 “Kollision Visualiseringer”).
figur 17.3., Kollision Visualiseringer
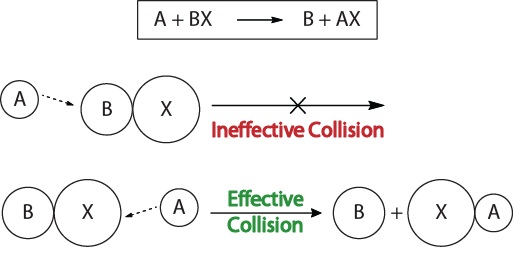
Denne visualisering viser en ineffektiv og effektiv kollision baseret på molekylære orientering.
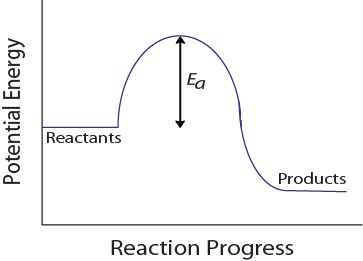
under en molekylær kollision skal molekyler også have en minimal mængde kinetisk energi for at en effektiv kollision kan forekomme. Denne energi varierer for hver reaktion og er kendt som aktiveringsenergien (EA) (figur 17.4 “potentiel energi og aktiveringsenergi”)., Reaktionshastigheden afhænger derfor af aktiveringsenergien; en højere aktiveringsenergi betyder, at færre molekyler vil have tilstrækkelig energi til at gennemgå en effektiv kollision.
figur 17.4. Potentiel energi og aktiveringsenergi
faktorer, der påvirker hastigheden
Der er fire hovedfaktorer, der kan påvirke reaktionshastigheden for en kemisk reaktion:
1. Reaktant koncentration., Forøgelse af koncentrationen af en eller flere reaktanter vil ofte øge reaktionshastigheden. Dette sker, fordi en højere koncentration af en reaktant vil føre til flere kollisioner af denne reaktant i en bestemt tidsperiode.
2. Reaktanternes fysiske tilstand og overfladeareal. Hvis der findes reaktantmolekyler i forskellige faser, som i en heterogen blanding, vil reaktionshastigheden begrænses af overfladearealet af de faser, der er i kontakt., For eksempel, hvis et fast metalreaktant og gasreaktant blandes, er det kun de molekyler, der er til stede på overfladen af metallet, der er i stand til at kollidere med gasmolekylerne. Derfor vil forøgelse af metaloverfladen ved at slå det fladt eller skære det i mange stykker øge dets reaktionshastighed.
3. Temperatur. En stigning i temperaturen typisk øger reaktionshastigheden. En stigning i temperaturen vil øge den gennemsnitlige kinetiske energi af reaktantmolekylerne., Derfor vil en større andel molekyler have den mindste energi, der er nødvendig for en effektiv kollision (figur. 17,5 “temperatur og reaktionshastighed”).
figur. 17.5 Temperatur og reaktionshastigheden
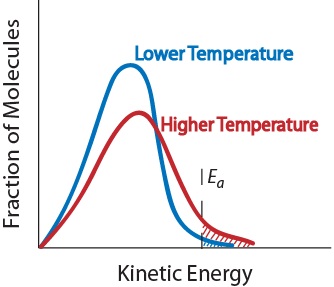
4. Tilstedeværelse af en katalysator. En katalysator er et stof, der fremskynder en reaktion ved at deltage i det uden at blive forbrugt. Katalysatorer tilvejebringer en alternativ reaktionsvej for at opnå produkter., De er kritiske for mange biokemiske reaktioner. De vil blive undersøgt yderligere i afsnittet ” katalyse.”
nøgle Takea .ays
- reaktioner opstår, når to reaktantmolekyler effektivt kolliderer, hver med minimal energi og korrekt orientering.
- Reaktantkoncentration, reaktanternes fysiske tilstand og overfladeareal, temperatur og tilstedeværelsen af en katalysator er de fire vigtigste faktorer, der påvirker reaktionshastigheden.