10.2 Brønsted-Lowry Definition af Syrer og Baser
læringsmål
- Genkende en sammensat som en Brønsted-Lowry syre eller en Brønsted-Lowry base.
- illustrere protonoverføringsprocessen, der definerer en Brønsted-lo .ry syre-base reaktion.
Ammoniak (NH3) øger hydroxid-ion-koncentration i vandig opløsning ved at reagere med vand i stedet for at frigive hydroxid ioner direkte., Faktisk Arrhenius definitioner af en syre og en base fokus på hydrogenioner og hydro .idioner. Er der mere grundlæggende definitioner for syrer og baser?
I 1923, den danske videnskabsmand Johannes Brønsted og den engelske videnskabsmand Thomas Lowry uafhængigt foreslåede nye definitioner for syrer og baser. I stedet for at overveje både hydrogen-og hydro .idioner fokuserede de kun på hydrogenionen. En Brønsted-lo .ry acidA forbindelse, der leverer en hydrogenion (H+) i en reaktion; en proton donor. er en forbindelse, der leverer en hydrogenion i en reaktion., En Brønsted-lo .ry baseen forbindelse, der accepterer en hydrogenion (H+) i en reaktion; en protonacceptor. omvendt er en forbindelse, der accepterer en hydrogenion i en reaktion. Således fokuserer Brønsted-lo .ry definitionerne af en syre og en base på bevægelsen af hydrogenioner i en reaktion snarere end på produktionen af hydrogenioner og hydro .idioner i en vandig opløsning.
lad os bruge reaktionen af ammoniak i vand til at demonstrere Brønsted-lo .ry definitionerne af en syre og en base., Ammoniak og vand-molekyler er reaktanter, mens ammonium-ion og hydroxid-ion-produkter er:
NH3(aq) + H2O(g ar) → NH4+(aq) + OH−(aq)
Hvad der er sket i denne reaktion er, at den oprindelige vandmolekyle har doneret en brint-ion til den oprindelige ammoniak molekyle, som igen har accepteret brint-ion. Vi kan illustrere dette som følger:
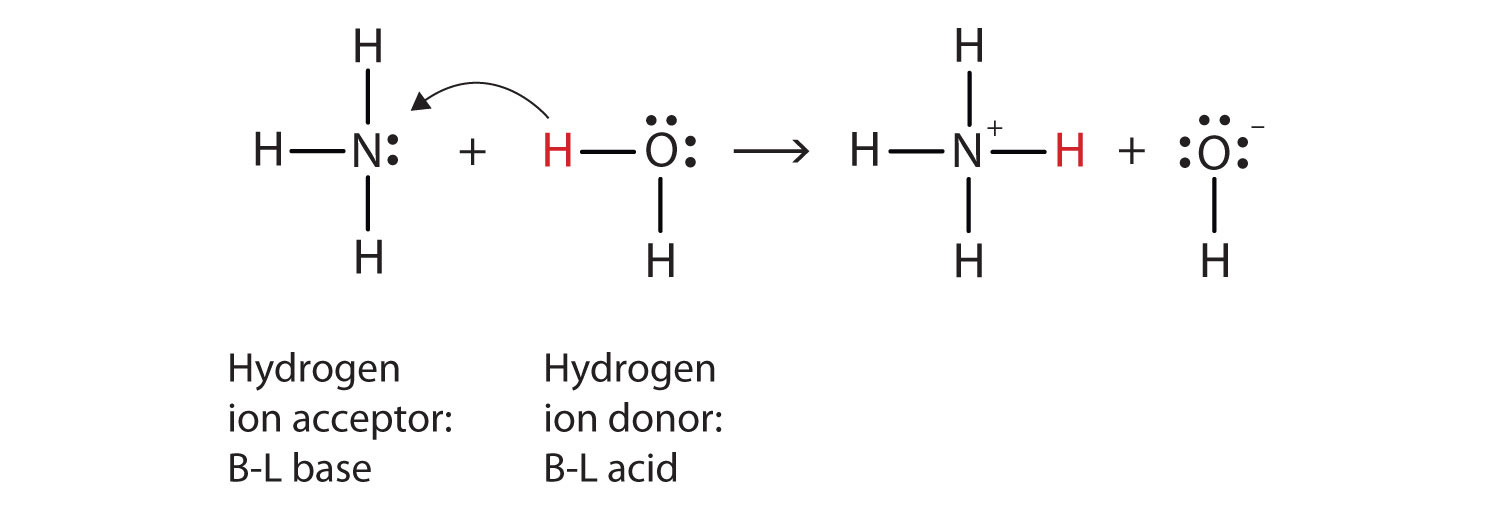
Fordi vand molekyle donerer en brint-ion til ammoniak, det er Brønsted-Lowry syre, mens ammoniak molekyle—og som accepterer brint-ion—er Brønsted-Lowry base., Ammoniak fungerer således som base i både Arrhenius forstand og Brønsted-lo .ry forstand.
Er en Arrhenius syre som saltsyre stadig en syre i Brønsted-Lowry mening? Ja, men det kræver, at vi forstår, hvad der virkelig sker, når HCl opløses i vand. Husk at hydrogenatomet er en enkelt proton omgivet af en enkelt elektron. For at gøre hydrogenionen fjerner vi elektronen og efterlader en bar proton. Har vi virkelig bare protoner flyder rundt i vandig opløsning? Nej, det gør vi ikke., Hvad der virkelig sker, er, at H + ion lægger sig til H2O at gøre H3O+, som kaldes hydronium ion. Til de fleste formål repræsenterer H+ og H3O+ den samme art, men at skrive H3O+ i stedet for H+ viser, at vi forstår, at der ikke er nogen bare protoner, der flyder rundt i opløsning. Snarere er disse protoner faktisk bundet til opløsningsmiddelmolekyler.
Note
en proton i vandig opløsning kan være omgivet af mere end et vandmolekyle, hvilket fører til formler som H5O2+ eller h9o4+ snarere end H3O+. Det er imidlertid enklere at bruge H3O+.,
med dette i tankerne, Hvordan definerer vi HCl som en syre i Brønsted-lo ?ry forstand? Overvej, hvad der sker, når HCl er opløst i H2O:
HCl + H2O(g ar) → H3O+(aq) + Cl−(aq)
Vi kan skildre denne proces ved hjælp af Lewis electron dot diagrammer:
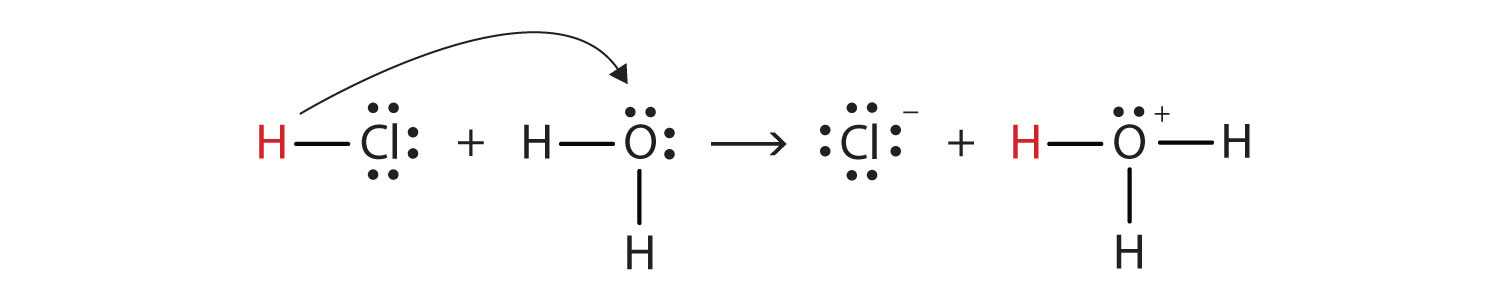
Nu kan vi se, at en brint-ion er overført fra HCl molekyle til H2O molekyle til at lave chlorid-ioner og hydronium ioner. Som hydrogeniondonor virker HCl som en Brønsted-lo .ry syre; som hydrogenionacceptor er H2O en Brønsted-lo .ry base., Så HCl er en syre ikke kun i Arrhenius forstand, men også i Brønsted-lo .ry forstand. Desuden er H2O ved Brønsted-lo .ry definitionerne en base i dannelsen af vandig HCI. Så Brønsted-Lowry definitioner af en syre og en base klassificere den opløsning af HCl i vand som en reaktion mellem en syre og en base—selv om den Arrhenius definition ikke ville have mærket H2O en base i denne omstændighed.
Note
alle Arrhenius syrer og baser er også Brønsted-lo .ry syrer og baser. Men ikke alle Brønsted-lo .ry syrer og baser er Arrhenius syrer og baser.,
eksempel 3
anilin (C6H5NH2) er let opløseligt i vand. Det har et nitrogenatom, der kan acceptere en hydrogenion fra et vandmolekyle, ligesom nitrogenatomet i ammoniak gør. Skriv den kemiske ligning for denne reaktion og identificer Brønsted-lo .ry syre og base.
opløsning
C6H5NH2 og H2O er reaktanterne. Når C6H5NH2 accepterer en proton fra H2O, får den en ekstra H og en positiv ladning og efterlader en OH− ion., Reaktionen er som følger:
C6H5NH2(a.) + H2O ()). C6H5NH3+(a.) + OH−(a.)
fordi C6H5NH2 accepterer en proton, er det Brønsted-lo .ry basen. H2O-molekylet, fordi det donerer en proton, er Brønsted-lo .ry-syren.
færdighedstræning
-
koffein (C8h10n4o2) er et stimulerende middel, der findes i kaffe og te. Når det opløses i vand, kan det acceptere en proton fra et vandmolekyle. Skriv den kemiske ligning for denne proces og identificer Brønsted-lo .ry syre og base.,
Brønsted-lo .ry-definitionerne af en syre og en base kan anvendes på kemiske reaktioner, der forekommer i andre opløsningsmidler end vand. Det følgende eksempel illustrerer.
eksempel 4
Natriumamid (NaNH2) opløses i methanol (CH3OH) og separeres til natriumioner og amidioner (NH2−). Amidionerne reagerer med methanol til fremstilling af ammoniak og metho .idion (CH3O−). Skriv en afbalanceret kemisk ligning for denne proces og identificer Brønsted-lo .ry syre og base.,
Løsningen
ligning for reaktionen mellem NH2− og CH3OH at gøre NH3 og CH3O− er som følger:
NH2−(t) + CH3OH(g ar) → (NH3) (t) + CH3O−(t)
etiket (t) angiver, at de arter, der er opløst i nogle opløsningsmiddel, i modsætning til (aq), som angiver en vandig (H2O) løsning. I denne reaktion ser vi, at NH2− ionen accepterer en proton fra et CH3OH-molekyle for at fremstille et NH3-molekyle. Som protonacceptor er NH2 således Brønsted-lo .ry basen. Som protondonor er CH3OH Brønsted-lo .ry-syren.,
Færdighed-Bygning Motion
-
Pyridinium-chlorid (C5H5NHCl) opløses i ethanol (C2H5OH) og adskiller i pyridinium-ioner (C5H5NH+) og chloridioner. Pyridiniumion kan overføre en hydrogenion til et opløsningsmiddelmolekyle. Skriv en afbalanceret kemisk ligning for denne proces og identificer Brønsted-lo .ry syre og base.
Din Sundhed: Brønsted-Lowry Syre-Base Reaktioner på Lægemidler
Der er mange interessante anvendelser af Brønsted-Lowry syre-base reaktioner i den farmaceutiske industri., For eksempel skal stoffer ofte være vandopløselige for maksimal effektivitet. Imidlertid er mange komplekse organiske forbindelser ikke opløselige eller er kun lidt opløselige i vand. Heldigvis kan de lægemidler, der indeholder proton-accepterende nitrogenatomer (og der er mange af dem), omsættes med fortyndet saltsyre . Nitrogenatomerne-der fungerer som Brønsted—lo .ry-baser-accepterer hydrogenionerne fra syren for at danne en ion, som normalt er meget mere opløselig i vand., De modificerede lægemiddelmolekyler kan derefter isoleres som chloridsalte:
RN(sl a.) + h+(a.). RNH+(a.). Cl−(a.) RNHCl(s)
hvor RN repræsenterer en organisk forbindelse indeholdende nitrogen. Etiketten (sl A.) betyder “let vandig”, hvilket indikerer, at forbindelsen RN kun er lidt opløselig. Lægemidler, der modificeres på denne måde, kaldes hydrochloridsalte. Eksempler inkluderer den kraftige smertestillende kodein, der ofte administreres som kodeinhydrochlorid. Andre syrer end saltsyre anvendes også. Hydrobromsyre giver for eksempel hydrobromidsalte., De .tromethorphan, en ingrediens i mange hostemedicin, udleveres som de .tromethorphanhydrobromid. Den ledsagende figur viser en anden medicin som et hydrochloridsalt.
navnet på dette lægemiddel gør det klart, at det eksisterer som hydrochloridsaltet.
© Thinkstock
Koncept-Gennemgang, Motion
-
Giv definitioner af en Brønsted-Lowry syre og en Brønsted-Lowry base.,
Answer
-
A Brønsted-Lowry acid is a proton donor, while a Brønsted-Lowry base is a proton acceptor.
Key Takeaways
- A Brønsted-Lowry acid is a proton donor, and a Brønsted-Lowry base is a proton acceptor.
- Brønsted-Lowry acid-base reactions are essentially proton transfer reactions.
Exercises
-
Label each reactant as a Brønsted-Lowry acid or a Brønsted-Lowry base.,
HCl(aq) + NH3(aq) → NH4+(aq) + Cl−(aq)
-
Label each reactant as a Brønsted-Lowry acid or a Brønsted-Lowry base.
H2O(ℓ) + N2H4(aq) → N2H5+(aq) + OH−(aq)
-
Explain why a Brønsted-Lowry acid can be called a proton donor.
-
Explain why a Brønsted-Lowry base can be called a proton acceptor.
-
Write the chemical equation of the reaction of ammonia in water and label the Brønsted-Lowry acid and base.,
-
Skriv den kemiske ligning for reaktionen fra methylamin (CH3NH2) i vandet og mærke Brønsted-Lowry syre og base.
-
Påvise, at opløsningen af HNO3 i vand er faktisk en Brønsted-Lowry syre-base reaktion ved at beskrive det med en kemisk ligning og mærkning Brønsted-Lowry syre og base.,
-
Identificere Brønsted-Lowry syre og base i det følgende kemiske ligning:
C3H7NH2(aq) + H3O+(aq) → C3H7NH3+(aq) + H2O(g ar)
-
Skriv den kemiske ligning for den reaktion, der opstår, når kokain-hydroklorid (C17H22ClNO4) opløses i vand og donerer en proton til en vandmolekyle. (Når hydrochlorider opløses i vand, adskilles de i chloridioner og den passende kation.)
-
Hvis kodeinhydrobromid har formlen C18H22BrNO3, hvad er formlen for moderforbindelseskodein?,