Indledning
Alkener og alkyner er kulbrinter, som henholdsvis har carbon-carbon-dobbeltbinding, og carbon-carbon tredobbelt binding funktionelle grupper. De molekylære formler af disse umættede carbonhydrider afspejler multipelbindingen af de funktionelle grupper:
alkener er navngivet som om de var alkaner, men “-ane”- suffikset ændres til “- en”., Hvis Alken kun indeholder en dobbeltbinding, og at dobbeltbindingen er terminal (dobbeltbindingen er i den ene ende af molekylet eller en anden), er det ikke nødvendigt at placere noget nummer foran navnet.,
butan: C4H10 (CH3CH2CH2CH3)
butene: C4H8 (CH2=CHCH2CH3)
Hvis dobbeltbinding er ikke terminal (hvis det er på en carbon et eller andet sted i midten af kæden) derefter kul skal være nummereret på en sådan måde, at de giver den første af de to dobbelt-bundet kulstof de lavest mulige nummer, og dette nummer skal gå forud for den “ene” suffiks med en bindestreg, som vist nedenfor.,
korrekt: pent-2-en (CH3CH=CHCH2CH3)
forkert: pent-3-ene (CH3CH2CH=CHCH3)
Den anden er forkert, fordi flippe formlen vandret resulterer i et lavere antal for alken.
Hvis der er mere end en dobbeltbinding i en alken, skal alle bindingerne nummereres i molekylets navn – endda terminale dobbeltbindinger. Tallene skal gå fra laveste til højeste og adskilles fra hinanden med et komma. IUPAC-numeriske præfikser bruges til at angive antallet af dobbeltbindinger.,
octa-2,4-dien: CH3CH=CHCH=CHCH2CH2CH3
deca-1,5-dien: CH2=CHCH2CH2CH=CHCH2CH2CH2CH3
Bemærk, at nummereringen af “2-4″ ovenfor giver et molekyle med to dobbeltbindinger, der er adskilt af blot en enkelt obligation. Dobbeltbindinger i en sådan tilstand kaldes” konjugerede”, og de repræsenterer en forbedret stabilitet af konformation, så de er energisk begunstiget som reaktanter i mange situationer og kombinationer.,
| Alkane | CnH2n+2 | Dette er det maksimale H/C-forholdet for et givet antal kulstof-atomer. |
|---|---|---|
| Alken | CnH2n | hver dobbeltbinding reducerer antallet af hydrogenatomer med 2. |
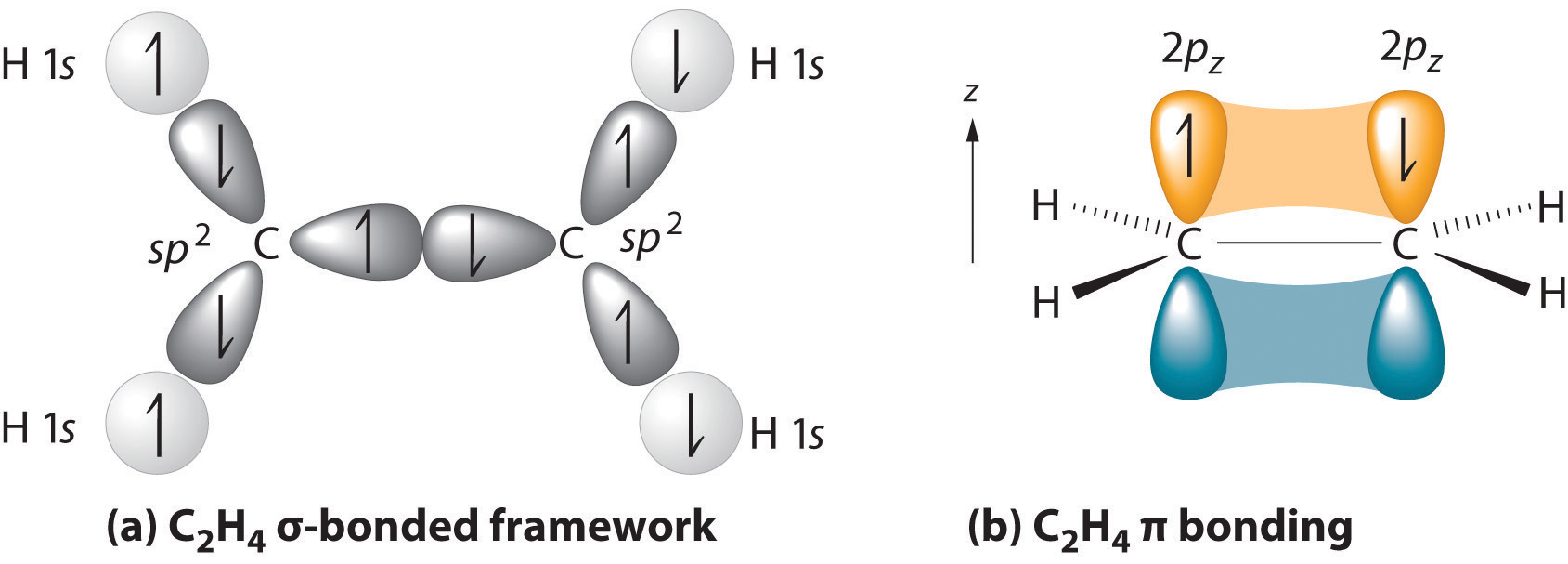
forældrestrukturen er den længste kæde, der indeholder begge carbonatomer i dobbeltbindingen., De to kulstofatomer i en dobbeltbinding og de fire atomer, der er knyttet til dem ligge i et plan, med bindingsvinkler på ca 120° En dobbeltbinding består af en sigma obligation, dannet ved overlapning af sp2 hybrid orbitals og en pi-bond, der dannes ved overlapning af parallelle 2 p orbitals
molekylformlen for et carbonhydrid giver information om de mulige strukturelle typer, det kan repræsentere. For eksempel overveje forbindelser med formlen C5H8., Formlen for fem-carbon-alkanpentanen er C5H12, så forskellen i hydrogenindhold er 4. Denne forskel antyder, at sådanne forbindelser kan have en tredobbelt binding, to dobbeltbindinger, en ring plus en dobbeltbinding eller to ringe. Nogle eksempler er vist her, og der er mindst fjorten andre!