indtil videre har vi set på måderne, hvorpå par af atomorbitaler kan kombineres for at danne molekylære orbitaler-for at danne bindinger. Ligesom vi tænker på, at der er en progression af atomare orbitaler fra laveste energi til højeste (1s, 2s, 2p, 3s…), kan vi organisere disse molekylære orbitaler efter rækkefølge af deres energi.
i høj grad kan rækkefølgen af molekylære orbitaler i energi anses for at følge af rækkefølgen af de atomare orbitaler, hvorfra de er konstrueret., Der er nogle afvigelser fra denne regel, nogle gange, men det er det enkleste sted at starte. Så i et molekyle ville de laveste energimolekylære orbitaler være dem, der er dannet af atomorbitalerne med laveste energi, 1s-orbitalerne.
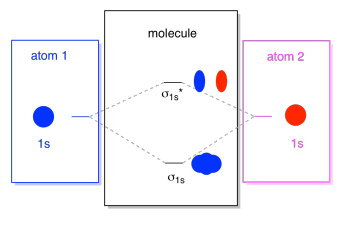
hvad vi ser her er et molekylært orbital interaktionsdiagram. Midten af diagrammet er bare det molekylære orbitale energidiagram. Det er analogt med det atomare kredsløbsenergidiagram (som går 1s, 2s, 2p, 3s…). Rækkefølgen af energi hidtil er .1s, .1s*., Siderne af diagrammet henviser bare tilbage til, hvor disse molekylære orbitaler kom fra, med stiplede linjer for at guide dig fra et sted til et andet. Alt i alt, billedet siger, at 1s orbital på et atom og 1s orbital på den anden atom kan kombinere på to forskellige måder, der producerer den lavere energi, limning σ1s og højere energi, antibonding σ1s*.
Bemærk, at vi ikke har tilføjet nogen elektroner til det molekylære orbital energidiagram endnu, men når vi gør det, vil vi bare udfylde dem fra bunden op, ligesom vi ville have et atomisk orbital energidiagram.,
det næste laveste sæt atomare orbitaler er 2s-niveauet. Disse sfæriske orbitaler ville kombinere meget som 1s orbitaler, og vi ville få et lignende diagram, kun på et lidt højere energiniveau.
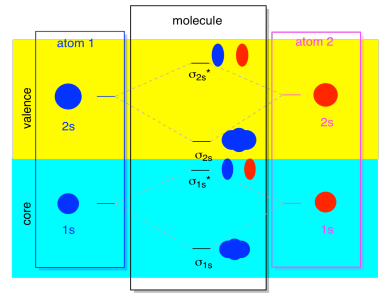
det meste af tiden vil vi ikke se både σ1 ‘erne og22’ erne, der vises i diagrammet. Det skyldes, at hvis der er nogen 2s elektroner, så er disse 1s elektroner virkelig kerneelektroner, ikke Valens. De er begravet lidt dybere i atomet, og de spiller ikke en meget vigtig rolle i binding., At ignorere kerneelektronerne er ret almindeligt; hvis du husker, kan vi i atomelektronkonfigurationer skrive 2s22p4 i stedet for 1s22s22p4 for ilt; vi ignorerede kernen. Da vi tegnede Le .is-strukturer, vi gav ilt seks elektroner, snarere end otte; vi ignorerede kernen.
i forbindelse med MO, formoder vi har 2s elektroner. Det må betyde, at hvert atom har to 1s elektroner af sig selv, for i alt fire. Når disse fire elektroner er fyldt i MO-diagrammet fra bunden op, vil de optage både bindingen .1s og antibonding .1s*., Virkningen af begge disse kombinationer, der er optaget, er at annullere bindingen; disse to par elektroner forbliver ikke-binding. Så vi kan ignorere dem, og vi mangler ikke rigtig noget.
2s-orbitalerne er ikke de eneste i den anden skal. Der er også 2P orbitaler. Husk, at der er et par meget forskellige måder, hvorpå p-orbitaler kan kombinere med hinanden, afhængigt af hvilken akse de ligger. Hvis de ikke ligger parallelt med hinanden – det vil sige, hvis de er vinkelret på hinanden, såsom en P and og en py-så kan de ikke interagere med hinanden overhovedet., P.på et atom kunne interagere med P. på det andet atom, men fordi de er parallelle med hinanden.
normalt definerer vi axis-aksen som liggende langs linjen mellem de to atomer, vi ser på. To pz orbitals ville ligge langs denne akse, hver med en lap der strækker sig ud i rummet mellem de atomer, og hver med en anden lap udvide væk, i den anden retning
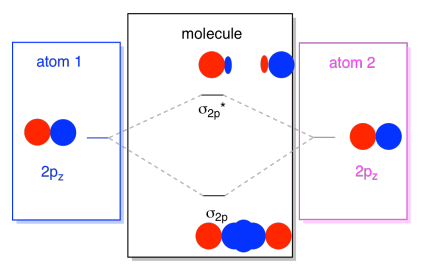
Den deraf følgende kombinationer kaldes σ, fordi de ikke ligge langs aksen mellem atomer (det er præcis, hvad σ midler i form af binding)., Der er en σ-kombination, hvis de overlappende lobes er i fase med hinanden, og combination* – kombination, hvis disse lobes er ude af fase med hinanden. Fordi disse nye orbitaler stammer fra atomare 2P orbitaler, kalder vi dem .2p og .2p*.
Der er også de p-orbitaler, der ikke ligger langs bindingsaksen eller aksen mellem de to atomer. P. – orbitalerne er vinkelret på de p. – orbitaler, vi lige har set på, og derfor vinkelret på aksen mellem bindingerne. Men de er stadig parallelle med hinanden, og de kan stadig danne kombinationer., Disse to orbitaler ville danne en in-fase kombination og en out-of-fase kombination.
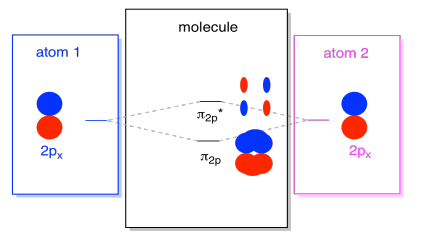
Bemærk, at den energiske adskillelse mellem disse to kombinationer er lidt mindre end afstanden mellem levels2p og .2p* niveauerne. Forskellen er relateret til graden af overlapning mellem atomare orbitaler. Orbitalerne på aksen projicerer stærkt ind i det samme rum; de overlapper meget, og de interagerer stærkt. Off-a .is orbitalerne børster mod hinanden, interagerer mindre stærkt og resulterer i mindre energiske ændringer., Afstanden mellem n2p orbital og n2p* orbital er derfor meget mindre end den mellem or2p og22p* orbitaler.
Der er faktisk to af disse off-a .is p orbitaler. Ud over p. – sættet ville vi have et py-sæt. Hvis p. – sættet er i skærmens plan, har py-Sættet en orbital, der stikker ud foran og en skjult bag. Ikke desto mindre er kombinationerne mellem de to py-orbitaler nøjagtigt de samme som det, vi så mellem de to p. – orbitaler. De drejes bare til et vinkelret plan i forhold til p. – kombinationerne.,
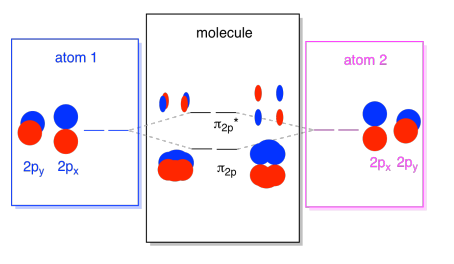
Vi kan sætte alle disse 2p-baserede orbitaler sammen i et diagram. Det begynder at blive lidt mere overfyldt, men dette diagram er bare en kombination af de stykker, vi allerede har set. Bemærk, at p., Py og p atomic atomare orbitaler alle starter på samme energi (vi har stablet dem her, så du stadig kan se sammenhængen mellem atomare og molekylære orbitaler). Det betyder, at n2p & n2p* orbitaler vil blive “indlejret” mellem σ2p & .2p* orbitaler.,
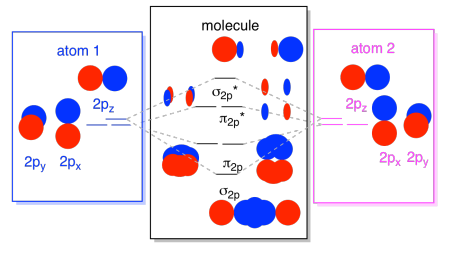
endelig, idet vi husker, at 2p-orbitalerne er højere i energi end 2s-orbitalerne, kan vi kombinere disse billeder i et diagram. Igen har vi set disse individuelle stykker før; vi samler dem bare nu.
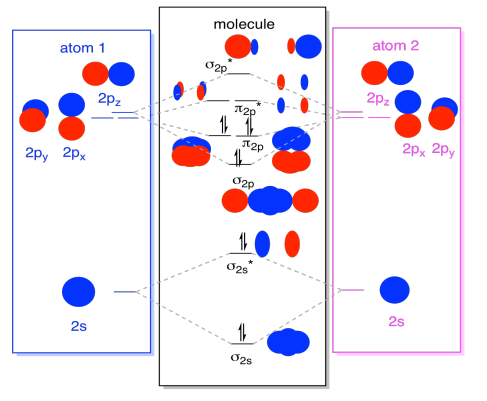
mens vi er ved det, kan vi tilføje elektronerne. Hvordan? Det er bare det samlede antal valenselektroner. For eksempel har vi brugt N2., Hvert nitrogen har fem valenselektroner, i alt ti, så vi har lige udfyldt ti elektroner, der starter i bunden af det molekylære orbital energiniveaudiagram. Hvis dette var et andet molekyle, såsom F2 eller O2, ville vi konstruere det samlede diagram på en lignende måde, men bare bruge et andet antal elektroner.det orbitalbillede, vi har beskrevet ovenfor, er virkelig bare et potentielt billede af den elektroniske struktur af dinitrogen (og enhver anden hovedgruppe eller p-blok diatomisk)., Vi får ikke et rigtigt billede af dinitrogens struktur, før vi befolker disse potentielle niveauer med elektroner.
- kun energiniveauerne med elektroner har indflydelse på molekylets energi (og adfærd).
med andre ord bestemmer elektronernes energi molekylets opførsel. De andre energiniveauer er kun muligheder, der forbliver uopfyldte.
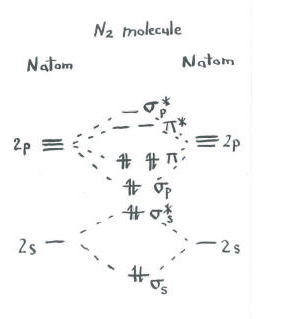
tænk på billedet af dinitrogen.
- hvert nitrogen har fem valenselektroner.
- Der er i alt ti elektroner.,
- to hver gå ind i S S limning og S s* antibonding niveauer. Husk, at vi holdt disse adskilt fra p-sættet som en forenkling.
- to går hver ind i S p-bindingen og hvert af p-bindingsniveauerne.de resterende orbitaler (S P* antibonding og hvert af p * antibonding niveauerne) er ikke besat. Disse er imaginære niveauer, der ikke spiller en rolle i bestemmelsen af dinitrogens energi. I en reel molekylær kredsløbsberegning ville elektronerne i disse niveauer bidrage til molekylets samlede energi.,
Vi får yderligere oplysninger fra dette billede. For eksempel kan vi se obligationsordren i dinitrogen.
- Bond order er kun antallet af bindinger mellem et par atomer.
- obligationsordren er en af flere faktorer, der påvirker styrken af den kovalente binding.jo højere bindingsrækkefølgen er, jo flere elektroner deles mellem atomerne, og jo stærkere bindingen.
i dinitrogen, s s limning s s* antibonding niveauer annullere hinanden ud. Et par er lavere i energi end det var i atomet, men det andet er højere., Der er ingen netto sænkning af energi. Disse elektroner bidrager ikke til en nitrogen-nitrogenbinding. Disse er ikke-bindende elektronpar.
de seks elektroner i S p-bindingen og p-bindingsniveauerne repræsenterer imidlertid et fald i energi fra energiniveauerne i de frie nitrogenatomer. Disse tre lavenergipar af elektroner indikerer tre bindinger mellem nitrogenatomerne.
Husk, vi har lavet nogle genveje i dette billede, og en reel molekylær orbitalberegning kunne give lidt forskellige resultater., Ikke desto mindre vil det stadig afsløre en bindingsordre på tre såvel som to ikke-bindende elektronpar.
derudover vises undertiden molekylære orbitale billeder på forskellige måder. Et molekylært orbitalt interaktionsdiagram viser, hvordan atom-eller molekylære orbitaler kombineres for at skabe nye orbitaler. Nogle gange kan vi være interesseret i kun de molekylære orbital energiniveauer selv, og ikke hvor de kom fra. Et molekylært orbital energiniveau diagram viser bare energiniveauerne i molekylet., Ofte, men ikke altid, vises energiniveaudiagrammer uden billeder af orbitalerne for at fokusere opmærksomheden på energiniveauerne, som på en grundlæggende måde er den vigtigste del af billedet. Fordi kun de besatte energiniveauer faktisk bidrager til molekylets energi, er undertiden den højere energi, ubesatte orbitaler udeladt af billedet.

Meget ofte resultaterne af molecular orbital beregninger styrke det, vi ville forudsige, fra Lewis-strukturer., Hvis du tegner en le .is-struktur af dinitrogen, vil du også forudsige en tredobbelt nitrogen-nitrogenbinding. Den største fordel ved molekylær orbital teori er, at den tillader kvantitativ forudsigelse af energi, når vi foretager en reel beregning på en computer. Derudover er det vigtigt at indse, at der ikke er nogen reel grund til oktetreglen, medmindre vi overvejer kvantemekanik. Le .is strukturer er baseret på en empirisk observation, at elektroner danner par og oktetter, uden at forsøge at forklare hvorfor., Molekylær orbital teori tager nogle grundlæggende relationer fra fysik og anvender dem til meget komplicerede molekyler med meget god succes. Kun ved at kende antallet af elektroner i molekylet, og ved at vide, omtrent hvor kerner er placeret i den struktur, molecular orbital beregninger giver meget nyttige oplysninger om energi. Derudover kan disse beregninger i mere komplicerede tilfælde end N2 endda rette vores første gæt om molekylær geometri og hvor bindingerne er placeret.,
øvelse \(\Pageinde. {2}\)
et molekylært Orbitaldiagram for et diatomisk molekyle (to atomer) varierer i antallet af elektroner. Hvordan befolker du elektronerne?
svar
• Tæl valenselektronerne på molekylet. Det er antallet af valenselektroner på hvert atom, justeret for enhver ladning på molekylet. C22 – har 10 valenselektroner: 4 fra hvert kulstof-det er 8 – og to mere til 2-ladningen).
• fyld elektroner i De laveste energi orbitaler først.
• par elektroner efter alle orbitaler på samme energiniveau har en elektron.,øvelse \(\Pageinde. {3}\)
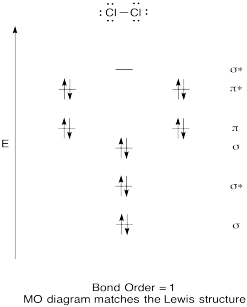
konstruer et kvalitativt molekylært orbitaldiagram for klor, Cl2. Sammenlign bond, for at den, der ses i Lewis struktur (husk, at en elektron i en antibonding orbital annullerer stabilisering på grund af binding af en elektron i en limning orbital).
Svar
Motion \(\PageIndex{4}\)
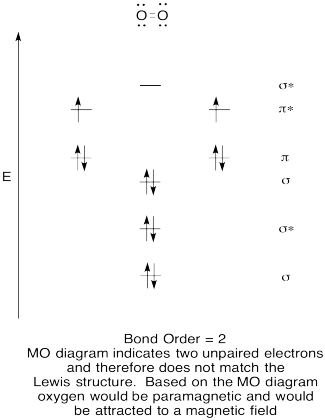
- Konstruere en kvalitativ molecular orbital diagram for ilt, O2.
- Sammenlign obligationsordren med den, der ses i Le .is-strukturen.,
- Hvordan sammenligner dette MO-billede af ilt ellers med Le ?is-strukturen? Hvad fortæller de to strukturer dig om elektronparring?
- forbindelser, der har alle deres elektroner parret, betegnes som diamagnetiske. Dem med uparrede elektroner kaldes paramagnetiske. Paramagnetiske materialer tiltrækkes af et magnetfelt, men diamagnetiske ting er det ikke. Hvordan ville du forvente Molekylær ilt til at opføre sig?,
Svar
Motion \(\PageIndex{5}\)
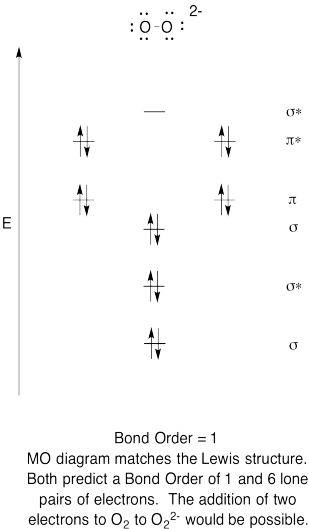
- Konstruere en kvalitativ molecular orbital diagram for peroxid anion, O22-.
- Sammenlign obligationsordren med den, der ses i Le .is-strukturen.
- Hvordan sammenligner dette MO-billede af ilt ellers med Le ?is-strukturen? Hvad fortæller de to strukturer dig om elektronparring?,
- baseret på molekylære orbitalbilleder, hvor let tror du, at dio ?ygen kunne reduceres til pero ?id (gennem tilsætning af to elektroner)?
Svar
Motion \(\PageIndex{6}\)
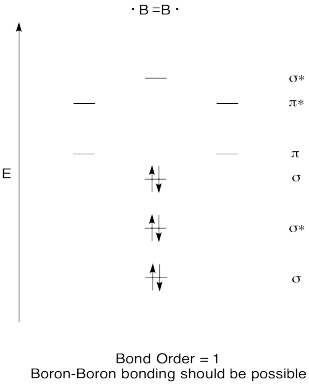
Konstruere en kvalitativ molecular orbital diagram for diboron, B2. Tror du, at Bor-Bor-obligationer let kunne dannes, baseret på dette billede?,
Svar
Motion \(\PageIndex{7}\)
- Konstruere en kvalitativ molecular orbital diagram for dicarbon, C2.
- Sammenlign obligationsordren med den, der ses i Le .is-strukturen.
- Hvordan sammenligner dette MO-billede af ilt ellers med Le ?is-strukturen? Hvad fortæller de to strukturer dig om elektronparring?,
Svar
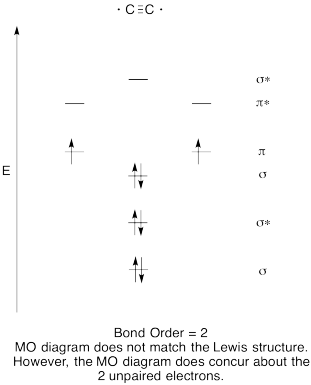
Motion \(\PageIndex{8}\)
- Konstruere en kvalitativ molecular orbital diagram for acetylide anion, C22-.
- Sammenlign obligationsordren med den, der ses i Le .is-strukturen.
- Hvordan sammenligner dette MO-billede af ilt ellers med Le ?is-strukturen? Hvad fortæller de to strukturer dig om elektronparring?,
- baseret på molekylære orbitalbilleder, hvor let tror du, at dicarbon kunne reduceres til acetylid (gennem tilsætning af to elektroner)?
Svar
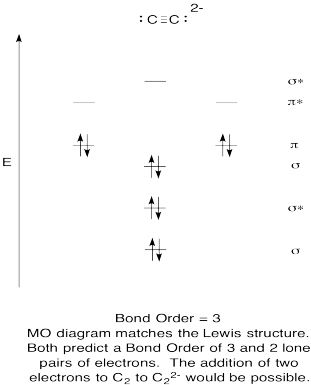
Motion \(\PageIndex{9}\)
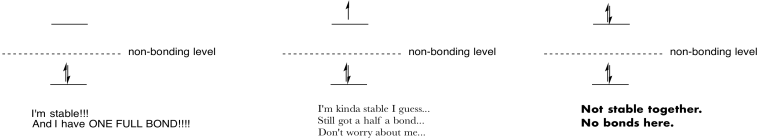
Gøre tegninger og noter til at opsummere effekten af befolker antibonding orbitals.
Svar
Attribution
Chris P Schaller, Ph. D.,, (College of Saint Benedict / Saint John ‘ s University)