studium kinetiky umožňuje vědcům určit vztah mezi změnami podmínek a rychlostí konkrétní chemické reakce. Jedním z nejdůležitějších faktorů, které ovlivňují rychlost reakce, je reaktivita chemikálií zapojených do této specifické reakce; kromě toho existuje několik proměnných, které mohou také ovlivnit rychlost reakce (koncentrace, teplota, katalyzátor atd.).
jedna z těchto proměnných je považována za kolizi.,
každá chemická reakce vyžaduje kolize mezi reakčními částicemi (atomy a/nebo molekulami). Na druhou stranu ne všechny kolize podporují reakci. Místo toho, pokud kolizní částice nemají dostatečnou kinetickou energii nebo správnou orientaci v prostoru, reakce nenastane.
ale co se rozumí “ dostatečnou energií „nebo“správnou orientací“? Chcete-li získat lepší představu o výše uvedených pojmech, článek poskytne některé obecné definice doprovázené odpovídajícími příklady a problémy se vzorkem.,
naším hlavním cílem je definovat koncept aktivační energie a vysvětlit, proč některé kolize nevedou k reakci.
proto se tento článek zaměří především na koncept reaktivní kolize. Spolu s tím budeme stručně shrnout některé scénáře zahrnující nereaktivní kolize. Vzhledem k tomu, že kolize jsou spojeny se dvěma hlavními charakteristikami, energií a prostorovou orientací, budeme o těchto podmínkách diskutovat.,
teorie kolizí
jak jsme již zmínili výše, musí dojít ke kolizím mezi dvěma nebo více molekulami, aby došlo k chemické reakci. Kolize však nestačí k tomu, aby se reaktanty přeměnily na produkty. Molekuly musí mít dostatek energie a musí se srazit se správnou prostorovou orientací.
jak již možná víte, existují různé typy reakcí, včetně syntézy, rozkladu, posunutí a spalování., Vzhledem k tomu, že teorie kolizí se zaměřuje na reakce zahrnující kolize mezi dvěma druhy, nemusíte se příliš obávat reakcí rozkladu, protože v takových případech se rozpadne jedna sloučenina a není třeba uvažovat o kolizích nebo orientaci částic ve vesmíru.
v případě reakcí zahrnujících dva druhy jsou srážky mezi molekulami rozhodující pro pokračování reakce; ale pouze srážky molekul s dostatečnou kinetickou energií a odpovídající prostorovou orientací mohou způsobit reakci., Energie je tedy potřebná k rozbití vazeb uvnitř reagujících molekul, zatímco orientace molekul v prostoru hraje důležitou roli při vzájemném uspořádání správných atomů, aby se správně reformovaly zlomené vazby.
pokud jsou splněna obě kritéria, je kolize považována za úspěšnou, účinnou nebo reaktivní kolizi.
vzhledem k významu výše uvedených dvou faktorů (energie a orientace) bychom měli pokračovat v dalším vysvětlení pojmů a konceptů, abychom lépe porozuměli principům teorie kolizí.,
aktivační energie
jak jsme již zmínili, částice se musí srazit s dostatečným množstvím energie, aby došlo k reakci. Tato minimální energie potřebná pro pokračování reakce je definována jako aktivační energie.,
Jak možná víte, existují dva typy reakcí týkajících se uvolňování nebo absorpce energie, které jsou následující:
- endotermická reakce – energie je absorbována v reakci (obvykle ve formě tepla)
- exotermická reakce – energie se uvolňuje v reakci (obvykle ve formě tepla)
na první pohled se může zdát, že vzhledem k tomu, že energie je uvolňována v exotermické reakci, nemělo by být nutné vkládat nějakou energii do těla.reakce se objeví. Naopak, endotermické a exotermické chemické reakce vyžadují energii, aby mohly začít.,
zdá se to trochu divné, že? Proč reakce potřebuje vstup energie, pokud je energie následně uvolněna?
podívejme se na následující příklady exotermických reakcí, které se vyskytují v našem každodenním životě.

Příklad #1-vypalování svíčky
spalování svíčky uvolňuje energii ve formě tepla; reakce, která se vyskytuje během procesu, je exotermická. Je zřejmé, že svíčku musíte zapálit pomocí zápalky nebo zapalovače., To znamená, že musíte zadat nějakou energii, aby se svíčka rozsvítila. Poté má reakce dostatečnou energii, aby mohla pokračovat v dalších krocích, a svíčka nadále spaluje energii.
svíčka však nikdy sama nehoří, že?
Příklad #2 – Osvětlení Zápas

typický zápas hlavy je složen ze síry ve směsi s různými oxidačními činidly. Chcete-li zapálit zápalku, měli byste otřít hlavu zápasu o speciální stranu krabičky na zápalky., Během tohoto procesu dochází k reakci a uvolňuje energii ve formě světla a tepla. Reakce je tedy považována za exotermickou. I když, stále je třeba zadat nějakou energii pro zápalku začít hořet. Tato energie je definována termínem “ aktivační energie.“Podobně jako v předchozím příkladu, pokud poskytnete dostatečnou energii, aby se zápalka rozsvítila, bude i nadále spalovat a uvolňovat teplo sama.
aktivační energetický graf zobrazuje energetické změny, ke kterým dochází během chemické reakce.,
spiknutí aktivační energie grafu, je důležité, aby zvážila dvě proměnné:
- Počet kolizí mezi různými molekulami
- Kinetická energie srážejících se molekul
první proměnná je poměrně snadné pochopit, protože to má přímý význam – definuje počet kolizí mezi částicemi ze dvou druhů za sekundu.
druhou proměnnou je kinetická energie kolizních molekul, kterou lze definovat jako energii pohybu molekul.
- endotermická reakce-energie je absorbována., Energie reaktantů je nižší než energie produktů.
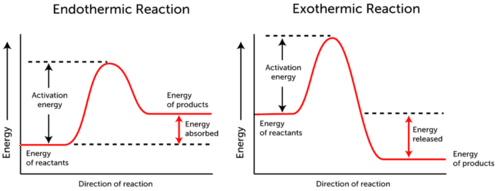
- exotermická reakce – energie je uvolněna. Energie reaktantů je více než energie produktů.
jak můžete vidět ve dvou grafech výše, aktivační energie pro obě, endotermické a exotermické reakce je stejná.,
Od endotermické reakce nemůže produkovat tolik energie, kolik potřebuje konzumovat za reakce nastat, energie je absorbována, a proto, energie produktů je vyšší než energie reaktantů.
exotermické reakce naopak produkují více energie, než používají jako aktivační energii. Výsledkem je uvolnění energie a produkty mají nižší energii než reaktanty.,
Na závěr lze konstatovat, že i když se molekuly reaktantu rychle srazí, je nezbytné, aby molekuly měly dostatečnou energii pro reakci.
prostorová orientace
podle teorie kolizí nejsou všechny kolize úspěšné, i když molekuly reaktantu mají dostatečnou aktivační energii. Molekuly musí také srazit správnou cestu kolem.
takže druhý aspekt, který ovlivňuje reaktivní kolize, je považován za prostorovou orientaci (orientace molekul v prostoru).,
Co znamená „správná“ orientace molekul v reakci?
když se dvě molekuly srazí, musí být obě molekuly umístěny tak, aby bylo snadné reagovat. Abychom plně porozuměli konceptu, je důležité zdůraznit mechanismus reakce.
podívejme se na reakci mezi propylenu (nebo propenu) a bromovodík jako příklad:

Jak můžete vidět výše, reakce probíhá ve 2 krocích.,
Krok 1: dvojná vazba je rozbité
Krok 2: brom je připojen
V této reakci, molekulární orientace HBr a C3H6 hrát důležitou roli, protože je jedním z nich byl umístěn v jiném způsobem, že by nebylo možné pro H atom přiblížit molekula propylenu.
to platí pro každou reakci. Každá molekula musí mít správnou orientaci v prostoru, aby reakce proběhla. Správná orientace zajišťuje, že molekuly jsou umístěny tak, že je pro ně relativně snadné srazit a reagovat.,
můžeme usoudit, že příznivá orientace molekul reaktantu je stejně důležitá jako dostatečná aktivační energie.
souhrn
pojmy a pojmy definované v celém článku jsou shrnuty v následující tabulce:
| teorie kolizí | vysvětluje, jak částice by měly interagovat nebo mezi sebou způsobit reakci., Podle Teorie Srážky, a to dvě kritéria musí být splněny, aby mohla chemická reakce proběhnout: Molekuly musí srazit s dostatečnou aktivační energii k odpočinku a re-formě existujících dluhopisů; Molekuly musí srazit s příznivou prostorovou orientaci. | ||
| úspěšná kolize (také označovaná jako účinná nebo reaktivní kolize) | kolize molekul s dostatečnou aktivační energií a správnou orientací v prostoru, která vede k chemické reakci., | ||
| aktivační energie | minimální energie potřebná k reakci. Vstup energie je potřebný v případě endotermických i exotermických reakcí. | ||
| Endotermické Reakce | Energie (tepla) je absorbován; energie reaktantů je NIŽŠÍ než energie produktů; Nemůže produkovat tolik energie, kolik se spotřebuje při reakci., | ||
| exotermická reakce | energie (teplo) se uvolňuje; energie reaktantů je vyšší než energie produktů; může produkovat více energie, než spotřebuje během reakce. | ||
| molekulární orientace | prostorová orientace molekul., |
Three different scenarios are represented in the picture attached below:
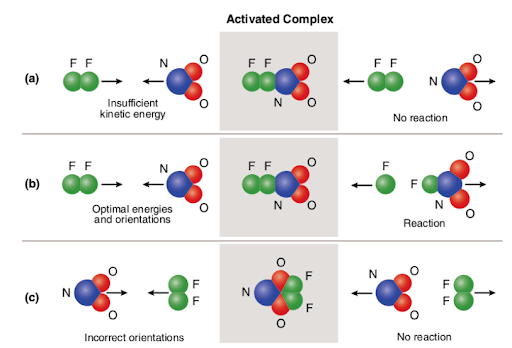
The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride.,
v případě (a) mají molekuly reaktantu správnou prostorovou orientaci, ale nemají dostatečnou aktivační energii; reakce se proto nevyskytuje kvůli skutečnosti, že není dostatek energie k přerušení vazeb. Takže kolize mezi oběma molekulami je považována za nereaktivní.
v případě (b) mají molekuly reaktantu dostatečnou aktivační energii i správnou orientaci v prostoru. Vzhledem k optimálním vlastnostem molekul dochází k reakci a vytváří se oxyfluorid dusíku., Takže kolize mezi oběma molekulami je považována za reaktivní.
V případě (c), molekuly reaktantu mít dostatečnou aktivační energii, ale nejsou řádně nachází v prostoru, Proto reakce neprobíhá, protože není možné, aby molekuly dostat jeden druhého způsobem, který ničí vazby. Podobně jako v prvním případě je tedy kolize mezi oběma molekulami považována za nereaktivní.