Richard Baxter a Jim Britton
jak ocel koroduje ve vodě?
abyste pochopili katodickou ochranu, musíte nejprve pochopit, jak je způsobena koroze. Aby došlo ke korozi, musí být přítomny tři věci:
1. Dva odlišné kovy
2. Elektrolyt (voda s jakýmkoli typem soli nebo solí rozpuštěných v něm)
3., Kovová (vodivá) cesta mezi odlišnými kovy
tyto dva odlišné kovy mohou být zcela odlišné slitiny-jako je ocel a hliník -, ale s větší pravděpodobností budou mikroskopické nebo makroskopické metalurgické rozdíly na povrchu jednoho kusu oceli. V tomto případě budeme zvažovat volně korodující ocel, která je nerovnoměrná.
pokud existují výše uvedené podmínky, probíhá na aktivnějších místech následující reakce 🙁 dva ionty železa plus čtyři volné elektrony).,
2Fe => 2Fe++ + 4e-
volné elektrony cestovat přes kovové cestu na méně aktivní místa, tam, kde tato reakce probíhá: (kyslík, plyn se převede na kyslík ion – tím, že kombinuje s čtyři volné elektrony – které spojuje s vodou za vzniku hydroxylových iontů).
O2 + 4e- + 2H20 => 4 OH-
Recombinations těchto iontů na aktivním povrchu produkují následující reakce, což dává železo-koroze produkt železných sodný: (žehlička kombinuje s kyslíkem a vodou za vzniku barevných sodný).,
2FE + O2 + 2H2O => 2FE (OH)2
tato reakce je častěji popisována jako “ proud protékající vodou z anody (aktivnější místo) do katody (méně aktivní místo).“
jak katodická ochrana zastaví korozi?
katodická ochrana zabraňuje korozi přeměnou všech anodických (aktivních) míst na kovovém povrchu na katodická (pasivní) místa dodáváním elektrického proudu (nebo volných elektronů) z alternativního zdroje.
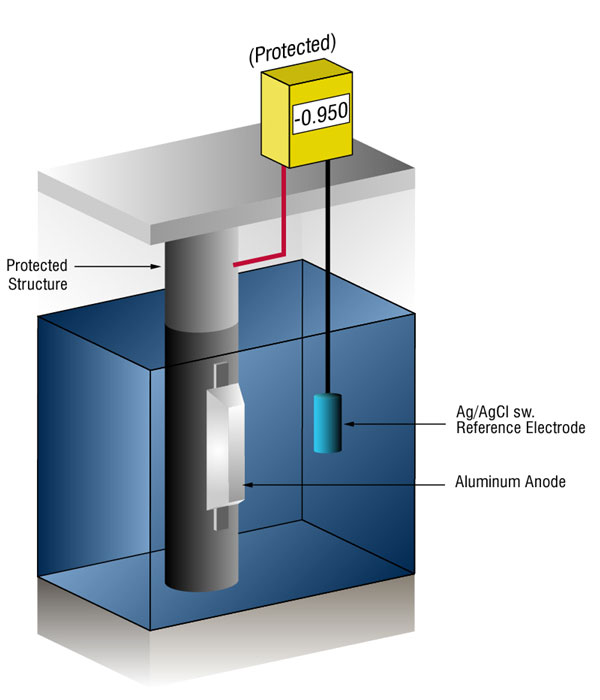
obvykle to má podobu galvanických anod, které jsou aktivnější než ocel., Tato praxe je také označována jako obětní systém, protože galvanické anody se obětují, aby chránily konstrukční ocel nebo potrubí před korozí.
v případě hliníkových anod je reakce na povrchu hliníku: (čtyři hliníkové ionty plus dvanáct volných elektronů)
4AL = > 4AL+++ + 12 e –
a na povrchu oceli: (kyslíkový plyn přeměněný na kyslíkové ionty, které se kombinují s vodou za vzniku hydroxylových iontů).,
3O2 + 12e- + 6H20 => 12OH-
Tak dlouho, dokud proudu (volných elektronů) dorazí na katodě (ocelová) rychleji než kyslík přijíždí, bez koroze dojde.,
Základní úvahy při navrhování obětní anoda systémy
elektrický proud anodou vypouštění je řízen ohmův zákon, který je:
I=E/R,
I= Proud v ampérech
E= Rozdíl v potenciálu mezi anodou a katodou ve voltech
R= Celkový odpor obvodu v ohmech
Zpočátku, proud bude vysoký, protože rozdíl v potenciálu mezi anodou a katodou je vysoké, ale jako potenciální rozdíl klesá v důsledku působení proudu na katodě, proud postupně klesá v důsledku polarizace katody., Odpor obvodu zahrnuje jak vodní cestu, tak kovovou cestu, která zahrnuje jakýkoli kabel v obvodu. Dominantní hodnotou je zde odolnost anody vůči mořské vodě.
u většiny aplikací je odpor kovu ve srovnání s odolností proti vodě tak malý, že jej lze ignorovat (i když to neplatí pro sáňky nebo dlouhé potrubí chráněné před oběma konci). Obecně platí, že dlouhé, tenké anody mají nižší odpor než krátké, tukové anody. Budou vypouštět více proudu, ale nebudou trvat tak dlouho.,
proto musí návrhář katodické ochrany rozměrovat anody tak, aby měly správný tvar a povrchovou plochu, aby vypustily dostatek proudu, aby chránily strukturu a dostatečnou hmotnost, aby vydržely požadovanou životnost při vybíjení tohoto proudu.
jako obecné pravidlo:
délka anody určuje, kolik proudu může anoda produkovat, a následně kolik čtverečních stop oceli může být chráněno. Průřez (hmotnost) určuje, jak dlouho může anoda udržet tuto úroveň ochrany.,
Impressed-current catodic protection systems (ICCP anode systems)
vzhledem k vysokým proudům zapojeným do mnoha systémů mořské vody není neobvyklé používat impressed-current systémy, které používají anody typu (ICCP anody), které se snadno nerozpouštějí do kovových iontů. To způsobuje alternativní reakci: oxidaci rozpuštěných chloridových iontů.
2CL – => Cl2 + 2e-
napájení je dodáváno externí stejnosměrnou jednotkou.,

jak víme, kdy máme dostatečnou katodickou ochranu?
můžeme ověřit, že je dost aktuální měřením potenciálu oceli proti standardní referenční elektroda, obvykle stříbro stříbro/chlorid (Ag/AgCl sw.), ale někdy zinek (sw.).
proudový tok na jakýkoli kov posune svůj normální potenciál v negativním směru. Historie ukázala, že pokud ocel přijímá dostatek proudu pro posun potenciálu na (-) 0.800 v vs., silver / silver chloride (Ag / AgCl), the corrosion is essentially stopped.
 |
 |