10.2 Brønsted-Lowryho Definice Kyseliny a zásady
Cíle Vzdělávání
- Rozpoznat sloučeniny jako Brønsted-Lowryho kyselina nebo Brønsted-Lowryho báze.
- ilustrují proces přenosu protonů, který definuje acidobazickou reakci Brønsted-Lowry.
Amoniak (NH3) zvyšuje sodný koncentrace iontů ve vodném roztoku reaguje s vodou, spíše než uvolnění hydroxidu ionty přímo., Ve skutečnosti se arrheniovy definice kyseliny a báze zaměřují na vodíkové ionty a hydroxidové ionty. Existují zásadnější definice kyselin a Zásad?
V roce 1923, dánský vědec Johannes Brønsted a anglický vědec Thomas Lowry nezávisle navrhované nové definice kyselin a zásad. Spíše než s ohledem na vodíkové i hydroxidové ionty se zaměřili pouze na vodíkový iont. Brønsted-Lowry acida sloučenina, která dodává vodíkový iont (H+) v reakci; dárce protonu. je sloučenina, která dodává vodíkový iont v reakci., Brønsted-Lowry basesloučenina, která přijímá vodíkový iont (H+) v reakci; protonový akceptor. naopak, je sloučenina, která přijímá vodíkový iont v reakci. Tak, Brønsted-Lowryho definice kyseliny a zásady, zaměřit se na pohybu vodíkových iontů v reakci, spíše než na produkci vodíkových iontů a hydroxidových iontů ve vodném roztoku.
použijeme reakci amoniaku ve vodě k prokázání Brønsted-Lowry definic kyseliny a báze., Amoniak a molekuly vody jsou reaktanty, zatímco amonný iont a hydroxidový iont jsou produkty:
NH3(aq) + H2O(ℓ) → NH4+(aq) + OH−(aq)
co se stalo v této reakci, je to, že původní molekula vody darovala vodíkový iont původní molekule amoniaku, která zase přijala vodíkový iont. Můžeme to ilustrovat takto:
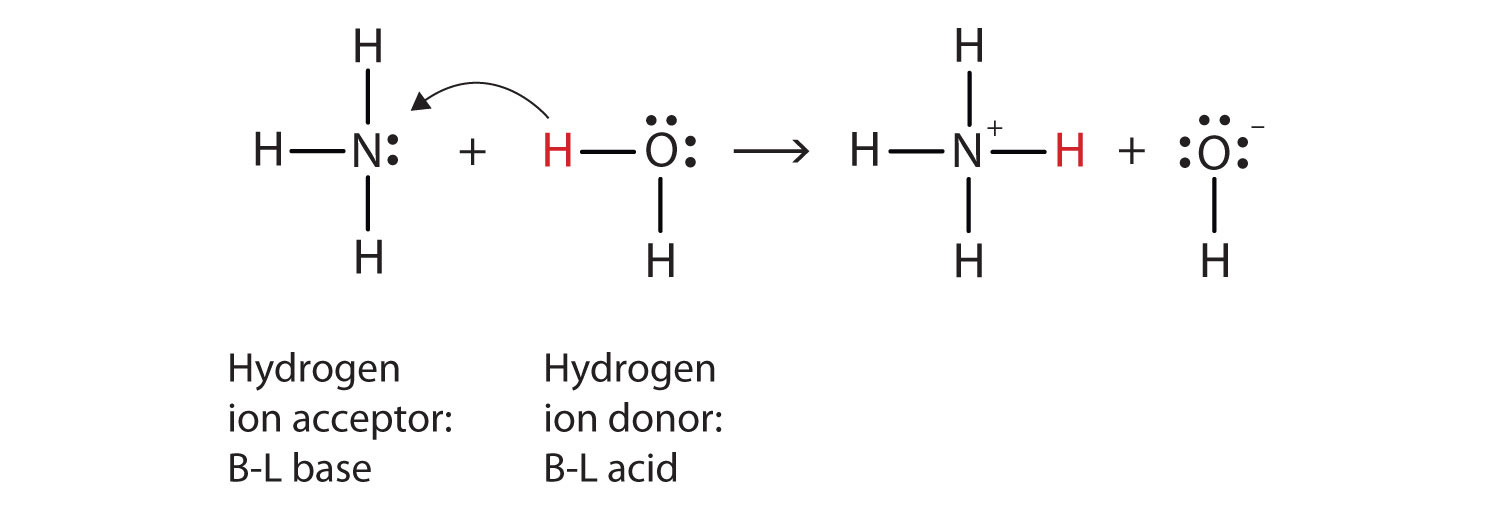
protože molekula vody daruje amoniaku vodíkový iont, je to kyselina Brønsted-Lowry, zatímco molekula amoniaku-která přijímá vodíkový iont-je Brønsted-Lowry base., Amoniak tedy působí jako základ jak v Arrheniově smyslu, tak v Brønsted-Lowry smyslu.
je kyselina Arrhenius jako kyselina chlorovodíková stále kyselina v Brønsted-Lowry smyslu? Ano, ale vyžaduje, abychom pochopili, co se skutečně stane, když se HCl rozpustí ve vodě. Připomeňme, že atom vodíku je jediný proton obklopený jediným elektronem. Abychom vytvořili vodíkový iont, odstraníme elektron a necháme holý proton. Máme opravdu holé protony plovoucí ve vodném roztoku? Ne, nemáme., Co se skutečně stane, je to, že H + ion se připojí k H2O, aby se H3O+, který se nazývá hydroniový iont. Pro většinu účelů představují H+ a H3O+ stejný druh, ale psaní H3O+ namísto H+ ukazuje, že chápeme, že v roztoku nejsou žádné holé protony. Spíše jsou tyto protony skutečně připojeny k molekul rozpouštědla.
Poznámka
proton ve vodném roztoku může být obklopen více než jednou molekulou vody, což vede k vzorcům jako H5O2+ nebo H9O4+ spíše než H3O+. Je však jednodušší použít H3O+.,
jak definujeme HCl jako kyselinu v Brønsted-Lowry smyslu? Zvažte, co se stane, když se HCl rozpustí v H2O:
HCl + H2O(ℓ) → H3O+(aq) + Cl−(aq)
tento proces můžeme znázornit pomocí Lewisových elektronových bodových diagramů:
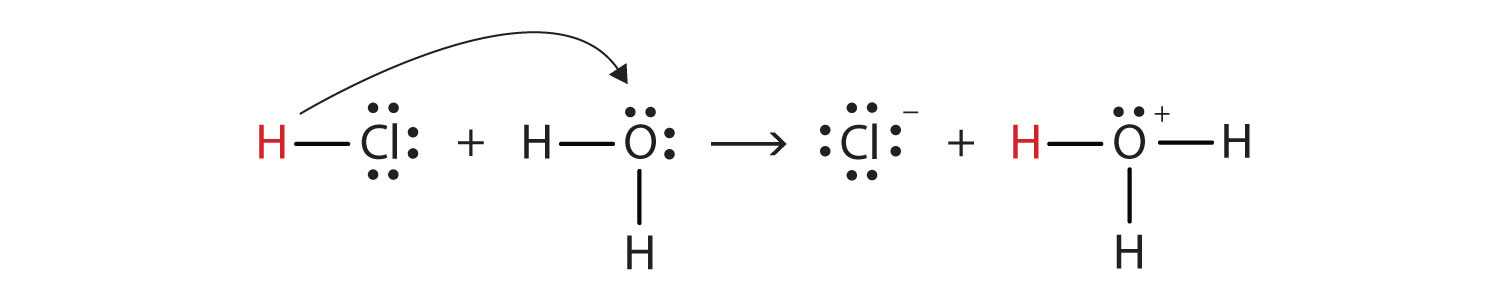
nyní vidíme, že se vodíkový iont přenáší z molekuly HCl na molekulu H2O, aby se vytvořily chloridové ionty a hydroniové ionty. Jako dárce vodíkových iontů působí HCl jako kyselina Brønsted-Lowry; jako akceptor vodíkových iontů je H2O Brønsted-Lowry base., HCl je tedy kyselina nejen v Arrheniově smyslu, ale také v Brønsted-Lowry smyslu. Navíc podle definic Brønsted-Lowry je H2O základem při tvorbě vodného HCl. Definice kyseliny Brønsted-Lowry a báze klasifikují rozpouštění HCl ve vodě jako reakci mezi kyselinou a bází—ačkoli definice Arrhenius by za těchto okolností neměla H2O báze.
Poznámka
všechny arrheniovy kyseliny a báze jsou také Brønsted-Lowry kyseliny a báze. Ale ne všechny Brønsted-Lowry kyseliny a báze jsou Arrhenius kyseliny a báze.,
příklad 3
anilin (C6H5NH2) je mírně rozpustný ve vodě. Má atom dusíku, který může přijmout vodíkový iont z molekuly vody, stejně jako atom dusíku v amoniaku. Napište chemickou rovnici pro tuto reakci a identifikujte kyselinu Brønsted-Lowry a báze.
roztok
C6H5NH2 a H2O jsou reaktanty. Když c6h5nh2 přijímá proton z H2O, získává další H a kladný náboj a zanechává OH− ion za sebou., Reakce je následující:
C6H5NH2(aq) + H2O(ℓ) → C6H5NH3+(aq) + OH−(aq)
Protože C6H5NH2 přijímá proton, to je Brønsted-Lowryho báze. Molekula H2O, protože daruje proton, je kyselina Brønsted-Lowry.
Dovednost-Budova Cvičení
-
Kofein (C8H10N4O2) je stimulant nalézt v kávy a čaje. Když se rozpustí ve vodě, může přijmout proton z molekuly vody. Napište chemickou rovnici pro tento proces a identifikujte kyselinu a základnu Brønsted-Lowry.,
Brønsted-Lowryho definice kyseliny a báze může být aplikován na chemické reakce, které se vyskytují v jiných rozpouštědlech než ve vodě. Následující příklad ilustruje.
příklad 4
amid sodný (NaNH2) se rozpouští v methanolu (CH3OH) a odděluje se na ionty sodíku a amidové ionty (NH2−). Amidové ionty reagují s methanolem za vzniku amoniaku a methoxidového iontu (CH3O−). Napište vyváženou chemickou rovnici pro tento proces a identifikujte kyselinu a báze Brønsted-Lowry.,
roztok
rovnice pro reakci je mezi NH2-a CH3OH pro výrobu NH3 a CH3O− je následující:
NH2−(solv) + CH3OH(ℓ) → NH3(solv) + CH3O−(solv)
štítek (solv) označuje, že druhy jsou rozpuštěny v nějakém rozpouštědle, na rozdíl od (aq), který určuje vodný roztok (H2O). V této reakci vidíme, že NH2-ion přijímá proton z molekuly CH3OH, aby vytvořil molekulu NH3. Tak, jako akceptor protonů, NH2 – je Brønsted-Lowry základna. Jako dárce protonu je ch3oh kyselinou Brønsted-Lowry.,
Dovednost-Budova Cvičení
-
mezi pyridiniové sodný (C5H5NHCl) se rozpouští v ethanolu (C2H5OH) a dělí mezi pyridiniové ionty (C5H5NH+) a chloridových iontů. Pyridiniový iont může přenášet vodíkový iont na molekulu rozpouštědla. Napište vyváženou chemickou rovnici pro tento proces a identifikujte kyselinu a báze Brønsted-Lowry.
Pro Vaše Zdraví: Brønsted-Lowryho Kyselina-Base Reakce ve farmaceutickém průmyslu
Existuje mnoho zajímavých aplikací Brønsted-Lowryho kyselina-base reakce ve farmaceutickém průmyslu., Například léky často musí být rozpustné ve vodě pro maximální účinnost. Mnoho komplexních organických sloučenin však není rozpustných nebo je jen mírně rozpustných ve vodě. Naštěstí ty léky, které obsahují atomy dusíku přijímající protony (a existuje mnoho z nich), mohou být reagovány zředěnou kyselinou chlorovodíkovou . Atomy dusíku-působící jako Brønsted—Lowry báze-přijímají vodíkové ionty z kyseliny, aby vytvořily iont, který je obvykle mnohem rozpustnější ve vodě., Modifikované molekuly léčiva pak mohou být izolovány jako chloridové soli:
RN ( sl aq)+H+(aq) → RNH + (aq) →Cl−(aq) RNHCl(s)
kde RN představuje nějakou organickou sloučeninu obsahující dusík. Označení (sl aq) znamená „mírně vodné“, což znamená, že sloučenina RN je pouze mírně rozpustná. Léky, které jsou tímto způsobem modifikovány, se nazývají hydrochloridové soli. Příklady zahrnují silný lék proti bolesti kodein, který se běžně podává jako kodein hydrochlorid. Používají se také jiné kyseliny než kyselina chlorovodíková. Například kyselina hydrobromová poskytuje hydrobromidové soli., Dextromethorphan, složka mnoha léků proti kašli, se vydává jako hydrobromid dextrometorfanu. Doprovodný obrázek ukazuje další lék jako hydrochloridovou sůl.
název tohoto léku jasně ukazuje, že existuje jako hydrochloridová sůl.
© Thinkstock
Koncept Přezkumu
-
Dát definice Brønsted-Lowryho kyseliny a Brønsted-Lowryho báze.,
Odpověď
-
Brønsted-Lowryho kyselina dárce protonu, zatímco Brønsted-Lowryho báze je proton akceptor.
key Takeaways
- a Brønsted-Lowry acid je donor protonu a Brønsted-Lowry base je akceptor protonu.
- Brønsted-Lowry acidobazické reakce jsou v podstatě protonové přenosové reakce.
cvičení
-
označit každý reaktivní jako Brønsted-Lowry kyseliny nebo Brønsted-Lowry báze.,
HCl (aq) + NH3(AQ) → NH4 + (AQ) + Cl−(AQ)
-
označte každý reaktivní jako Brønsted-Lowry kyselina nebo Brønsted-Lowry báze.
H2O(ℓ) + N2H4 (AQ) → N2H5 + (aq) + OH−(AQ)
-
vysvětlete, proč může být kyselina Brønsted-Lowry nazývána dárcem protonů.
-
vysvětlete, proč může být Brønsted-Lowry báze nazývána akceptorem protonů.
-
napište chemickou rovnici reakce amoniaku ve vodě a označte kyselinu Brønsted-Lowry a báze.,
-
napište chemickou rovnici reakce methylaminu (CH3NH2) ve vodě a označte Brønsted-Lowry kyselinu a báze.
-
ukazují, že rozpouštění HNO3 ve vodě je ve skutečnosti Brønsted-Lowry acidobazická reakce tím, že ji popisuje chemickou rovnicí a označuje Brønsted-Lowry kyselinu a báze.,
-
Identifikovat Brønsted-Lowryho kyseliny a báze v následující chemické rovnice:
C3H7NH2(aq) + H3O+(aq) → C3H7NH3+(aq) + H2O(ℓ)
-
Napište chemickou rovnici reakce, která nastane, když hydrochlorid kokainu (C17H22ClNO4) rozpouští se ve vodě a daruje proton k molekule vody. (Když se hydrochloridy rozpustí ve vodě, rozdělí se na chloridové ionty a odpovídající kationt.)
-
pokud má kodein hydrobromid vzorec C18H22BrNO3, jaký je vzorec mateřské sloučeniny kodeinu?,