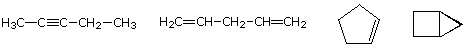Úvod
alkeny a alkyny jsou uhlovodíky, které mají dvojnou vazbu mezi uhlíkem a uhlíkem a uhlíkem trojná vazba funkční skupiny. Molekulární vzorce těchto nenasycených uhlovodíků odrážejí vícenásobné spojení funkčních skupin:
alkeny jsou pojmenovány, jako by to byly alkany, ale přípona“- ane „se změní na“ – ene“., Pokud Alken obsahuje pouze jednu dvojnou vazbu a že dvojitá vazba je koncová (dvojitá vazba je na jednom konci molekuly nebo jiné), není nutné umístit žádné číslo před jméno.,
butane: C4H10 (CH3CH2CH2CH3)
butene: C4H8 (CH2=CHCH2CH3)
Pokud dvojitá vazba není konečná (pokud je na uhlíku někde ve středu řetězce), měly by být uhlíky očíslovány v takovém případě.způsob, jak dát prvnímu ze dvou dvojitých uhlíků nejnižší možné číslo, a toto číslo by mělo předcházet příponě „ene“ pomlčkou, jak je znázorněno níže.,
správné: pent-2-en (CH3CH=CHCH2CH3)
chyby přiřazení nesprávné přípony: pent-3-en (CH3CH2CH=CHCH3)
druhá je nesprávná, protože proletí formule vodorovně výsledky v nižší číslo z alken.
Pokud existuje více než jednu dvojnou vazbu v to alken, všechny dluhopisy by měly být očíslovány ve jménu molekula – i terminální dvojné vazby. Čísla by měla jít od nejnižšího k nejvyššímu a měla by být od sebe oddělena čárkou. Číselné předpony IUPAC se používají k označení počtu dvojných vazeb.,
octa-2,4-diene: CH3CH=CHCH=CHCH2CH2CH3
deca-1,5-diene: CH2=CHCH2CH2CH=CHCH2CH2CH2CH3
všimněte si, že číslování „2-4“ nad výnosy a molekula se dvěma dvojnými vazbami oddělenými pouze jednou vazbou. Dvojité vazby v takovém stavu se nazývají „konjugované“ a představují zvýšenou stabilitu konformace, takže jsou energicky upřednostňovány jako reaktanty v mnoha situacích a kombinacích.,
| Alkan | CnH2n+2 | toto je maximální poměr H/C pro daný počet atomů uhlíku. |
|---|---|---|
| Alken | CnH2n | každá dvojná vazba snižuje počet atomů vodíku o 2. |
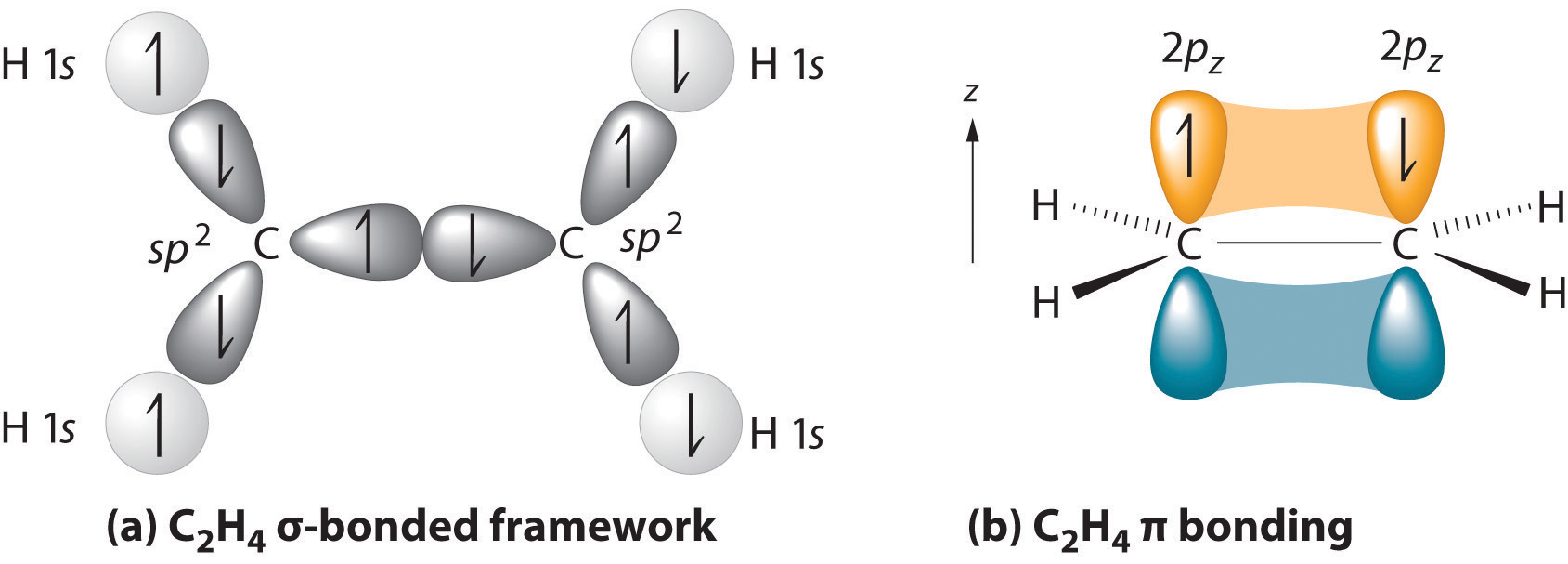
základní struktura je nejdelší řetězec obsahující oba atomy uhlíku dvojité vazby., Dva uhlíkové atomy dvojné vazby a čtyři atomy připojené k nim ležet v rovině, s bondem úhly zhruba 120° dvojná vazba se skládá z jedné sigma vazba tvořená překryvem sp2 hybridní orbitaly a jedna pi vazba tvořená překrytí paralelní 2 p orbitaly
molekulární vzorec uhlovodíku poskytuje informace o možných strukturních typech, které může představovat. Zvažte například sloučeniny, které mají vzorec C5H8., Vzorec pětiuhlíkového Alkan pentanu je C5H12, takže rozdíl v obsahu vodíku je 4. Tento rozdíl naznačuje, že takové sloučeniny mohou mít trojnou vazbu, dvě dvojité vazby, prsten plus dvojnou vazbu nebo dva kroužky. Některé příklady jsou zde uvedeny a existuje nejméně čtrnáct dalších!