dosud jsme se zabývali způsoby, jak by se páry atomových orbitalů mohly spojit a vytvořit molekulární orbitaly-tvořit vazby. Stejně jako si myslíme, že existuje progrese atomových orbitalů od nejnižší energie k nejvyšší (1s, 2s, 2p, 3s…), můžeme tyto molekulární orbitaly Uspořádat podle pořadí jejich energie.
do značné míry lze považovat pořadí molekulárních orbitalů v energii za následující z řádu atomových orbitalů, ze kterých jsou konstruovány., Někdy se od tohoto pravidla odchýlí, ale to je nejjednodušší místo, kde začít. Takže v molekule by molekulové orbitaly s nejnižší energií byly ty, které by vznikly z atomových orbitalů s nejnižší energií, 1s orbitalů.
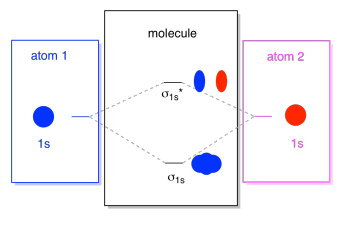
to, co zde vidíme, je molekulární orbitální interakční diagram. Uprostřed diagramu je pouze molekulární orbitální energetický diagram. To je analogické atomové orbitální energie diagramu (který jde 1s, 2s, 2p, 3s…). Pořadí energie je zatím σ1s, σ1s*., Strany diagramu se odkazují zpět na místo, odkud pocházejí tyto molekulární orbitaly, s tečkovanými čarami, které vás provedou z jednoho místa na druhé. Celkem, obrázek, říká, že 1s orbital na jednoho atomu a 1s orbitalu na druhý atom lze kombinovat dva různé způsoby, produkovat nižší-energie, lepení σ1s a vyšší energie, antibonding σ1s*.
Všimněte si, že jsme do tohoto diagramu molekulární orbitální energie ještě nepřidali žádné elektrony, ale když to uděláme, prostě je vyplníme zdola nahoru, stejně jako bychom měli schéma atomové orbitální energie.,
Další nejnižší sada atomových orbitalů je úroveň 2S. Tyto sférické orbitaly by se spojily velmi podobně jako 1s orbitaly a dostali bychom podobný diagram, pouze na mírně vyšší energetické úrovni.
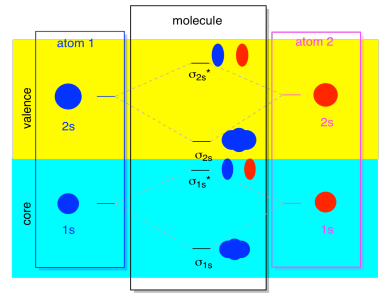
Většinu času, nebudeme vidět, jak σ1s a σ2s zobrazeny v diagramu. Je to proto, že pokud existují nějaké elektrony 2S, pak tyto elektrony 1s jsou opravdu jádrové elektrony, ne valence. Jsou pohřbeni trochu hlouběji v atomu a při lepení nehrají velmi důležitou roli., Ignorování jádrových elektronů je docela běžné; pokud si vzpomenete, v atomových elektronových konfiguracích bychom mohli napsat 2s22p4 místo 1s22s22p4 pro kyslík; ignorovali jsme jádro. Když jsme nakreslili Lewisovy struktury, dali jsme kyslíku šest elektronů, spíše než osm; ignorovali jsme jádro.
v kontextu MO předpokládejme, že máme elektrony 2S. To musí znamenat, že každý atom má dva vlastní elektrony 1s, celkem čtyři. Když jsou tyto čtyři elektrony vyplněny do MO diagramu zdola nahoru, zabírají jak vazby σ1s, tak antibonding σ1s*., Účinek obou těchto kombinací, které jsou obsazeny, je zrušit spojení; tyto dva páry elektronů zůstávají bez vazby. Takže je můžeme ignorovat a vlastně nám nic nechybí.
orbitaly 2S nejsou jediné v druhém shellu. Existují také 2p orbitaly. Pamatujte, že existuje několik velmi odlišných způsobů, jak se p orbitaly mohou vzájemně kombinovat, v závislosti na tom, na které ose leží. Pokud neleží paralelně k sobě-to znamená, že jsou kolmé k sobě, jako je px a py-pak nemohou vzájemně komunikovat., Pz na jednom atomu by však mohla interagovat s pz na druhém atomu, protože jsou navzájem rovnoběžné.
obvykle definujeme osu z jako ležící podél linie mezi dvěma atomy, na které se díváme. Dvě pz orbitaly by ležet podél této osy, každý s laloku rozšíření do prostoru mezi atomy, a každý s jinou lalok sahající daleko, v opačném směru,
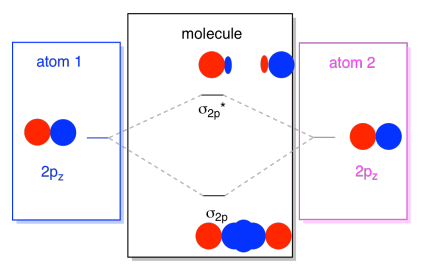
výsledná kombinace se nazývá σ, protože leží podél osy mezi atomy (to je přesně to, co σ znamená, pokud jde o lepení)., Existuje kombinace σ, pokud jsou překrývající se laloky ve fázi mezi sebou a σ* kombinace, pokud jsou tyto laloky mimo fázi. Protože tyto nové orbitaly vznikají z atomových 2p orbitálů, nazýváme je σ2p a σ2p*.
existují také ty P orbitaly, které neleží podél osy vazby nebo osy mezi dvěma atomy. Orbitaly px jsou kolmé k orbitálům Pz, na které jsme se právě dívali, a proto kolmé k ose mezi vazbami. Jsou však stále navzájem rovnoběžné a mohou stále vytvářet kombinace., Tyto dva orbitaly by tvořily ve fázi kombinaci a mimofázovou kombinaci.
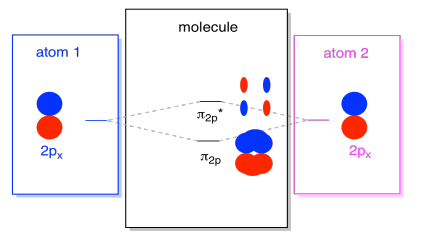
Všimněte si, že energetické rozdělení mezi tyto dvě kombinace je trochu menší, že rozdíl mezi σ2p a σ2p* úrovně. Rozdíl souvisí se stupněm překrytí mezi atomovými orbitaly. Orbitaly na ose se silně promítají do stejného prostoru; hodně se překrývají a silně interagují. Orbitaly mimo osu se navzájem kartáčují, interagují méně silně a vedou k menším energetickým změnám., Mezera mezi orbitalem n2p a orbitalem n2p* je proto mnohem menší než mezera mezi orbitaly σ2p a σ2p*.
ve skutečnosti existují dva z těchto mimoosých P orbitálů. Kromě sady px bychom měli sadu py. Pokud je sada px v rovině obrazovky, Sada py má jeden orbitální trčí vpředu a jeden skrytý za sebou. Nicméně, kombinace mezi dvěma py orbitaly jsou přesně stejné jako to, co jsme viděli mezi dvěma px orbitaly. Jsou právě otočeny do kolmé roviny s ohledem na kombinace px.,
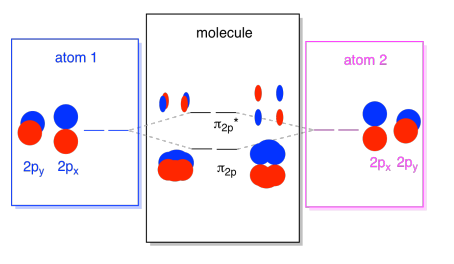
můžeme dát všechny tyto orbitaly založené na 2p dohromady do jednoho diagramu. Začíná to být trochu přeplněné, ale tento diagram je jen kombinací kusů, které jsme již viděli. Všimněte si, že atomové orbitaly px, py a pz začínají na stejné energii (zde jsme je naskládali ,takže stále můžete vidět korelaci mezi atomovými a molekulárními orbitaly). To znamená, že n2p & n2p* orbitaly se být „vnořené“ mezi σ2p & σ2p* orbitaly.,
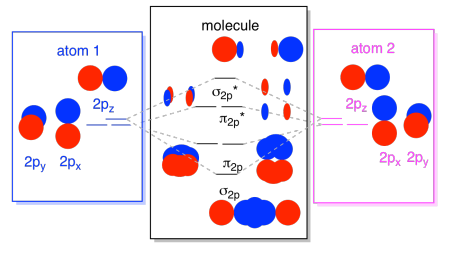
Konečně, udržet v paměti, že 2p orbitaly mají vyšší energii než orbitaly 2s, můžeme zkombinovat tyto obrázky do jednoho obrázku. Opět jsme viděli tyto jednotlivé kusy dříve; právě je sestavujeme.
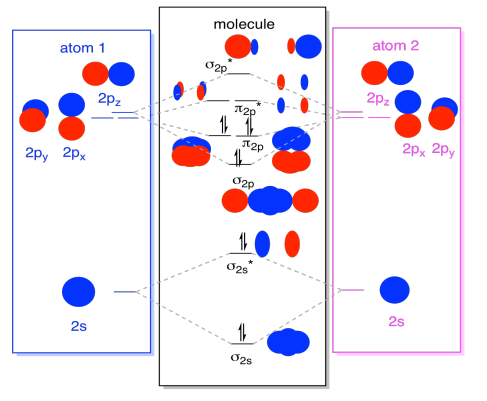
zatímco jsme u toho, můžeme přidat elektrony. Jak? Je to jen celkový počet valenčních elektronů. Například jsme použili N2., Každý dusík má pět valenčních elektronů, celkem deset, takže jsme právě vyplnili deset elektronů, počínaje spodní částí diagramu molekulární orbitální energetické hladiny. Pokud by se jednalo o jinou molekulu, jako je F2 nebo O2, vytvořili bychom celkový diagram podobným způsobem, ale použili bychom jiný počet elektronů.
orbitální obrázek jsme popsali výše, je opravdu jen potenciální obraz elektronová struktura oxidu (a žádné jiné hlavní skupině nebo p-bloku dvojmocné)., Nebudeme mít skutečný obraz struktury dinitrogenu, dokud tyto potenciální úrovně nenaplníme elektrony.
- pouze energetické hladiny s elektrony mají vliv na energii (a chování) molekuly.
jinými slovy energie elektronů určuje chování molekuly. Ostatní energetické hladiny jsou pouze možnosti, které zůstávají nenaplněné.
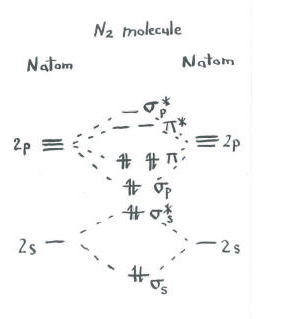
Přemýšlejte o obrázku dinitrogenu.
- každý dusík má pět valenčních elektronů.
- existuje celkem deset elektronů.,
- dva každý jít do S S lepení a s s * antibonding úrovně. Pamatujte, že jsme je drželi odděleně od sady p jako zjednodušení.
- dva jdou do vazby s p a každá z úrovní vazby p.
zbývající orbitaly (S P* antibonding a každá z úrovní P * antibonding) jsou neobsazeny. Jedná se o imaginární úrovně, které nehrají roli při určování energie dinitrogenu. Při skutečném molekulárním orbitálním výpočtu by elektrony v těchto úrovních přispěly k celkové energii molekuly.,
z tohoto obrázku získáváme další informace. Například můžeme vidět pořadí vazby v dinitrogenu.
- pořadí vazeb je jen počet vazeb mezi párem atomů.
- dluhopisový řád je jedním z několika faktorů, které ovlivňují sílu kovalentní vazby.
- čím vyšší je pořadí vazby, tím více elektronů je sdíleno mezi atomy a čím silnější je vazba.
v dinitrogenu se hladiny S S bonding s s* antibonding navzájem ruší. Jeden pár má nižší energii než v atomu, ale druhý je vyšší., Neexistuje žádné čisté snížení energie. Tyto elektrony nepřispívají k vazbě dusíku a dusíku. Jedná se o nespojné elektronové páry.
šest elektronů ve spojení s p a úrovně vazby p však představuje pokles energie z energetických hladin volných atomů dusíku. Tyto tři nízkoenergetické páry elektronů ukazují tři vazby mezi atomy dusíku.
nezapomeňte, že jsme na tomto obrázku provedli několik zkrat a skutečný molekulární orbitální výpočet by mohl přinést mírně odlišné výsledky., Nicméně, to by ještě odhalit pořadí vazby tří, stejně jako dva non-lepení elektronových párů.
kromě toho jsou někdy molekulární orbitální obrázky zobrazeny různými způsoby. Molekulární orbitální interakční diagram ukazuje, jak se atomové nebo molekulární orbitaly spojují a vytvářejí nové orbitaly. Někdy nás mohou zajímat pouze samotné molekulární orbitální energetické hladiny, a ne odkud pocházejí. Schéma molekulární orbitální energetické hladiny jen ukazuje energetické hladiny v molekule., Často, ale ne vždy, jsou diagramy úrovně energie zobrazeny bez obrázků orbitalů, aby se zaměřila pozornost na energetické hladiny, které jsou zásadním způsobem nejdůležitější součástí obrazu. Navíc, protože pouze obsazené energetické hladiny skutečně přispívají k energii molekuly, někdy jsou z obrazu vynechány neobsazené orbitaly s vyšší energií.

Velmi často výsledky molekulární orbitální výpočty posílit to, co bychom předpovědět z Lewis struktury., Pokud nakreslíte Lewisovu strukturu dinitrogenu, budete také předpovídat trojitou vazbu dusíku a dusíku. Hlavní výhodou molekulární orbitální teorie je, že umožňuje kvantitativní predikci energie, když provádíme skutečný výpočet na počítači. Kromě toho je důležité si uvědomit, že neexistuje žádný skutečný důvod pro pravidlo oktetu, pokud neuvažujeme o kvantové mechanice. Lewisovy struktury jsou založeny na empirickém pozorování, že elektrony tvoří páry a oktety, aniž by se pokoušely vysvětlit proč., Molekulární orbitální teorie má některé základní vztahy z fyziky a aplikuje je na velmi komplikované molekuly s velmi dobrým úspěchem. Jen na základě znalosti počtu elektronů v molekule, a tím, že ví přibližně, kde jádra jsou umístěny ve struktuře, molekulární orbitální výpočty poskytují velmi užitečné informace o energie. Navíc, ve složitějších případech než N2, tyto výpočty mohou dokonce opravit náš první odhad molekulární geometrie a kde jsou vazby umístěny.,
Cvičení \(\PageIndex{2}\)
Molekulární Orbitální Diagram pro dvouatomová molekula (dva atomy) se liší v počtu elektronů. Jak se vám naplnit elektrony?
odpověď
* Spočítejte valenční elektrony na molekule. To je počet valenčních elektronů na každém atomu, upravený pro jakýkoli náboj na molekule. C22-má 10 valenčních elektronů: 4 z každého uhlíku – to je 8 – a další dva pro 2-náboj).
• nejprve vyplňte elektrony do nejnižších energetických orbitalů.
• párové elektrony koneckonců orbitaly na stejné energetické úrovni mají jeden elektron.,
cvičení \(\PageIndex{3}\)
Vytvořte kvalitativní molekulární orbitální diagram pro chlor, Cl2. Porovnat dluhopisů, aby na to viděl v Lewis struktura (pamatujte, že elektron v antibonding orbitální zruší stabilizační vzhledem k lepení elektronu v lepení orbital).
odpověď 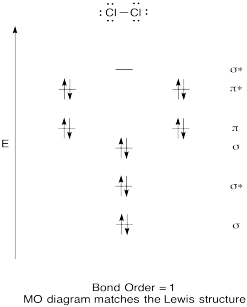
cvičení \(\PageIndex{4}\)
- Vytvořte kvalitativní molekulární orbitální diagram pro kyslík, O2.
- Porovnejte pořadí vazby s pořadí viděným v Lewisově struktuře.,
- jak jinak se tento pohyb kyslíku porovnává s Lewisovou strukturou? Co vám tyto dvě struktury říkají o párování elektronů?
- sloučeniny, které mají všechny své elektrony spárované, se označují jako diamagnetické. Ty s nepárovými elektrony jsou označovány jako paramagnetické. Paramagnetické materiály jsou přitahovány magnetickým polem, ale diamagnetické věci nejsou. Jak byste čekali, že se bude chovat molekulární kyslík?,
Odpověď
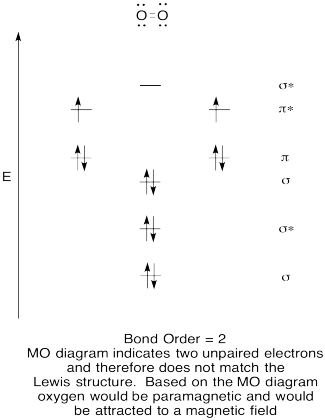
Cvičení \(\PageIndex{5}\)
- Vytvořit kvalitativní molekulární orbitální diagram pro vodíku anion, O22-.
- Porovnejte pořadí vazby s pořadí viděným v Lewisově struktuře.
- jak jinak se tento pohyb kyslíku porovnává s Lewisovou strukturou? Co vám tyto dvě struktury říkají o párování elektronů?,
- na základě molekulárních orbitálních obrázků, jak snadno si myslíte, že dioxygen může být redukován na peroxid (přidáním dvou elektronů)?
odpověď
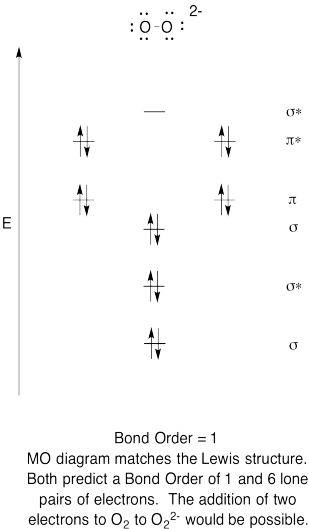
cvičení \(\PageIndex{6}\)
Vytvořte kvalitativní molekulární orbitální diagram pro diboron, B2. Myslíte si, že by se bórové bórové vazby mohly snadno vytvořit na základě tohoto obrázku?,
Odpověď
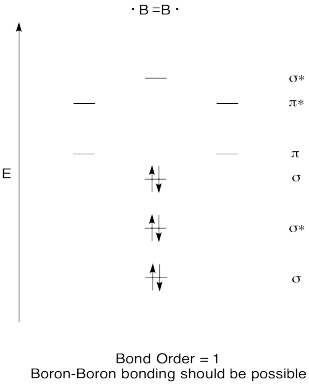
Cvičení \(\PageIndex{7}\)
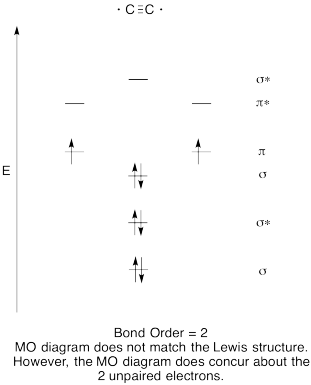
- Vytvořit kvalitativní molekulární orbitální diagram pro dicarbon, C2.
- Porovnejte pořadí vazby s pořadí viděným v Lewisově struktuře.
- jak jinak se tento pohyb kyslíku porovnává s Lewisovou strukturou? Co vám tyto dvě struktury říkají o párování elektronů?,
Odpověď
Cvičení \(\PageIndex{8}\)
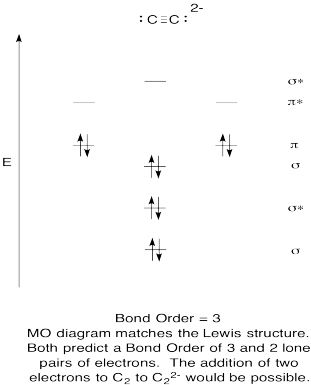
- Vytvořit kvalitativní molekulární orbitální diagram pro acetylide anion C22-.
- Porovnejte pořadí vazby s pořadí viděným v Lewisově struktuře.
- jak jinak se tento pohyb kyslíku porovnává s Lewisovou strukturou? Co vám tyto dvě struktury říkají o párování elektronů?,
- na základě molekulárních orbitálních obrazů, jak snadno si myslíte, že by mohl být dikarbon redukován na acetylid (přidáním dvou elektronů)?
odpověď
cvičení \(\PageIndex{9}\)
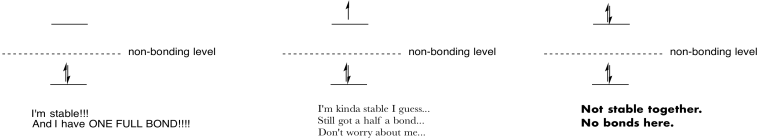
vytvářet výkresy a poznámky, které shrnují účinek vyplnění antibondingových orbitálů.
Odpověď
Atribuce
Chris P Schaller, Ph.d.,, (Vysoká škola svatého Benedikta / univerzita svatého Jana)