cíle učení
- získat pochopení teorie kolizí.
- získat pochopení čtyř hlavních faktorů, které ovlivňují rychlost reakce.
reakční kinetika je studium rychlosti chemických reakcí a reakční rychlosti se mohou značně lišit ve velkém rozsahu časových měřítek. Některé reakce mohou probíhat výbušně rychle, jako je detonace ohňostrojů (obrázek 17.,1 „Ohňostroj v Noci Nad Řekou“), zatímco jiní se mohou objevit v pomalý růst po mnoho let jako rezavějícího ostnatého drátu vystaveny prvky (viz Obrázek 17.2 „Zrezivělý Ostnatý Drát“).
obrázek 17.1. Ohňostroj v noci nad řekou

chemická reakce v ohňostroji se děje výbušnou rychlostí.
obrázek 17.2. Zrezivělý ostnatý drát

rezivění ostnatého drátu probíhá po mnoho let.,
teorie kolizí
abychom porozuměli kinetice chemických reakcí a faktorům, které ovlivňují kinetiku, měli bychom nejprve prozkoumat, co se děje během reakce na molekulární úrovni. Podle kolizní teorie reaktivity dochází k reakcím, když se molekuly reaktantu „účinně srazí.“Aby došlo k „účinné kolizi“, musí být molekuly reaktantu správně orientovány v prostoru, aby se usnadnilo lámání a formování vazeb a přeskupení atomů, které vedou k tvorbě molekul produktu (obrázek 17.3 „vizualizace kolizí“).
obrázek 17.3., Vizualizace kolizí
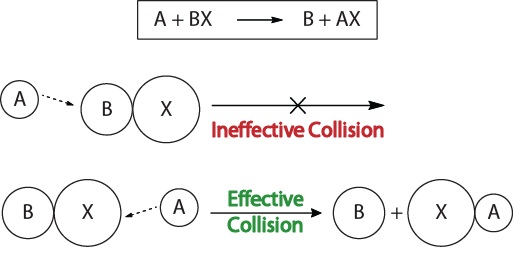
tato vizualizace ukazuje neúčinnou a účinnou kolizi založenou na molekulární orientaci.
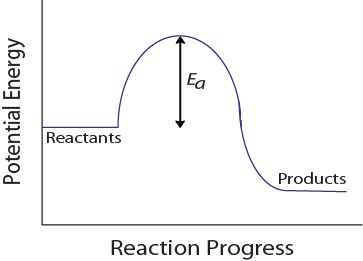
během molekulární kolize musí molekuly mít také minimální množství kinetické energie, aby došlo k účinné kolizi. Tato energie se liší pro každou reakci a je známá jako aktivační energie (Ea) (obrázek 17.4 „potenciální energie a aktivační energie“)., Rychlost reakce proto závisí na aktivační energii; vyšší aktivační energie znamená, že méně molekul bude mít dostatečnou energii k účinnému kolizi.
obrázek 17.4. Potenciální Energie a Aktivační Energie
faktory, které ovlivňují rychlost
existují čtyři hlavní faktory, které mohou ovlivnit reakční rychlost chemické reakce:
1. Koncentrace reaktantu., Zvýšení koncentrace jednoho nebo více reaktantů často zvýší rychlost reakce. K tomu dochází, protože vyšší koncentrace reaktantu povede k více kolizím tohoto reaktantu v určitém časovém období.
2. Fyzický stav reaktantů a povrchové plochy. Pokud molekuly reaktantu existují v různých fázích, jako v heterogenní směsi, rychlost reakce bude omezena povrchovou plochou fází, které jsou v kontaktu., Například pokud se smísí reaktant pevného kovu a reaktant plynu, pouze molekuly přítomné na povrchu kovu se mohou srazit s molekulami plynu. Proto zvýšení povrchové plochy kovu tím, že ho buší do roviny nebo rozřezá na mnoho kusů, zvýší jeho reakční rychlost.
3. Teplota. Zvýšení teploty obvykle zvyšuje rychlost reakce. Zvýšení teploty zvýší průměrnou kinetickou energii molekul reaktantu., Proto bude mít větší podíl molekul minimální energii potřebnou pro účinnou kolizi (obrázek. 17,5 „teplota a reakční rychlost“).
obrázek. 17.5 teplota a reakční rychlost
4. Přítomnost katalyzátoru. Katalyzátor je látka, která urychluje reakci tím, že se na ní podílí, aniž by byla spotřebována. Katalyzátory poskytují alternativní reakční cestu k získání produktů., Jsou kritické pro mnoho biochemických reakcí. Budou dále zkoumány v sekci “ katalýza.“
Klíčové Takeaways
- reakce se vyskytují, když se dvě molekuly reaktantu účinně srazí, z nichž každá má minimální energii a správnou orientaci.
- koncentrace reaktantu, fyzikální stav reaktantů a povrchová plocha, teplota a přítomnost katalyzátoru jsou čtyři hlavní faktory, které ovlivňují reakční rychlost.